化学実験、バイオ実験のノウハウなど、毎日の実験・分析に役立つ情報をお届け。

フローサイトメトリー(5/5) フローサイトメトリーを用いたセルソーティング
リケラボ実験レシピシリーズ
前項までに、フローサイトメトリーを用いることで、細胞の表面抗原や特定タンパク質の発現を計測し、細胞集団の中から目的の細胞をリアルタイムに識別できることをご紹介しました。
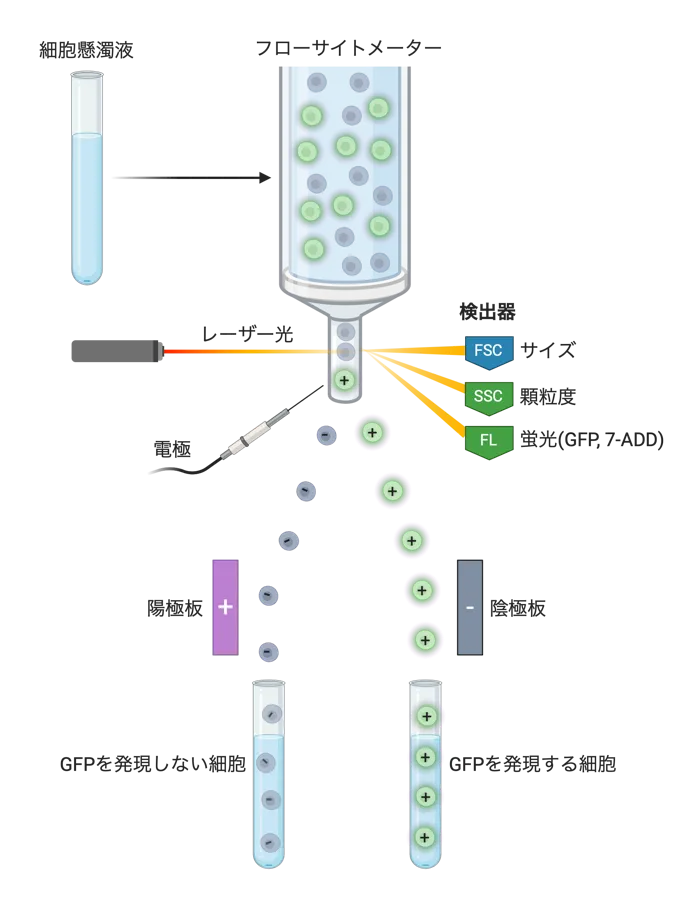
本項では、このフローサイトメトリーによる細胞識別をもとに、細胞集団の中から任意の細胞を一つ一つ選別して回収するセルソーティング技術をご紹介します。セルソーティングは、アナライザー機能に加えてソーティング機能が搭載されたフローサイトメーターを用いて行います。ソーティング機能が搭載されたフローサイトメーターでは細胞が1個ずつ含まれた液滴を調製でき、この多数の液滴の周囲の電場を変化させ、目的の液滴(細胞)のみを回収チューブの方向に移動させ、高精度かつ高速に分取することができます。特に、蛍光レポーター(GFPなど)や特徴的なマーカー分子を発現する特定の細胞(幹細胞など)を集団の中から、選別して、生きたまま取り出すことができる特徴をもちます。セルソーティングによって選び出された細胞は、そのまま純粋培養し、必要に応じて様々な解析に用いることができるため、特定の細胞種の機能解析あるいは幹細胞の移植医療など、生物学・医学には欠かせない技術の一つです[図1]。
では、フローサイトメトリーでGFP発現細胞をソーティングする実験手順の概略をご紹介しましょう。
必要な試薬と材料・機器
- 細胞培養試薬:培地、血清(FBS)、PBS、0.05%トリプシン-EDTA溶液など
- セルソーティングバッファ:FBS (1-2%)とEDTA (1 mM)を添加したPBS
- 死細胞染色剤:7-AAD (7-aminoactinomycin D)など
- セルストレーナー:フィルター(孔径40 µm)付き細胞回収チューブ(CORNING #352235など)
- セルソーティング機能付きフローサイトメーター(BD FACSAria / MoFlo / SONY SH800 など)
実験手順
1. 準備・培養
- GFP遺伝子をゲノムに組み込んだ細胞株(安定発現細胞株)または一過性にトランスフェクションした細胞株を培養する。
→ 接着細胞の場合、セルソーティングの当日に細胞培養密度が培養皿底面の6~9割を占めるよう調節する。
2. 細胞懸濁液の調製
<接着細胞の場合>
- 0.05%トリプシン-EDTAで処理することで、細胞を培養皿から剥離する。
- 血清(FBS)を添加した培地やPBSを加えてトリプシン反応を中和し、細胞を懸濁液として回収する。
- 遠心分離(300~400×g , 5分間)を行い、上清を除去する。
- セルソーティングバッファで細胞ペレットを再懸濁する。
<浮遊細胞の場合>
- 上記の手順1, 2をスキップし、手順3, 4を実施する。
*接着細胞と浮遊細胞のいずれに対しても、セルソーティングバッファには、細胞の生存を維持するために血清(FBS)を加え、細胞の凝集を防ぐためにEDTAを加える。
3. フィルトレーション
- 細胞懸濁液をセルストレーナー(孔径: 約40 µm)で濾過し、通過した細胞をチューブ等に回収する。
*細胞の凝集塊などでセルソーターのノズルが詰まることを未然に防ぐため。
4. 死細胞の染色
- GFPと蛍光スペクトル特性の重なりが小さく、細胞膜を透過しない核染色剤(7-ADDなど)を細胞懸濁液に加え、細胞膜が損傷した死細胞を染色する。
*死細胞をあらかじめ標識しておくことで、フローサイトメトリーのゲーティング機能で、試料中の生細胞(7-ADD陰性集団)を死細胞(7-ADD陽性集団)から選り分けて回収することができる。
*試料調製中のGFPや核染色剤の退色を最小限にするために、細胞懸濁液は遮光・低温で扱う。
*7-ADDの代わりに、DAPIやヨウ化プロピジウム(PI)を用いることもできる。
5. フローサイトメーターの蛍光検出器の設定
- GFP蛍光検出:励起波長488 nm(青レーザー)、検出チャネル(FITC, 530/30 nmフィルターなど)を選択する。
- 7-ADD (死細胞)検出:励起波長488 nm(青レーザー)、検出チャネル(FL3, >670 nm)を選択する。
*GFPと死細胞染色剤の間に蛍光スペクトルの部分的な重なりがある場合には、必要に応じて補償処理(コンペンセーション)を行う[フローサイトメトリー 第1,2項 を参照]。
フローサイトメトリー(1/5)概要と原理編
https://www.rikelab.jp/post/11249.html
フローサイトメトリー(2/5) プロトコル編
https://www.rikelab.jp/post/11250.html
6. GFPを発現する単一の生細胞を取得するゲート作製
- 細胞試料をフローサイトメーターに供する。
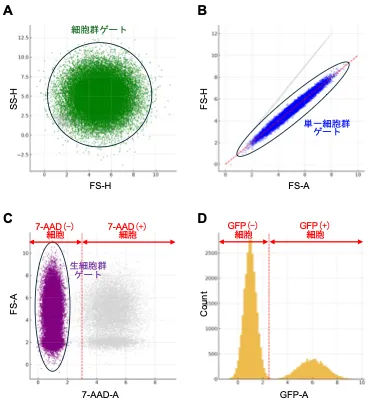
- X軸を前方散乱光パルスのピークの高さ(FS-H)、Y軸を側方散乱光パルスのピークの高さ(SS-H)とする散布図に全イベントを展開する。ここで試料中の主成分と思われる「細胞群」を示す集団を選抜する(緑:細胞群ゲート) [図2A]。
- 細胞群ゲート内の細胞を、X軸を前方散乱光パルスの面積(FS-A)、Y軸を前方散乱光パルスのピーク高さ(FS-H)とする散布図に展開する。ここで、FS-Aに対してFS-Hで直線上に並ぶ細胞の集団を単一細胞の集団として選抜する(青: 単一細胞群ゲート)[図2B]。
- 単一細胞群ゲート内の細胞を、X軸を7-AADの蛍光シグナルのパルス面積(7-AAD-A)、Y軸を前方散乱光パルスの面積(FS-A)とする散布図に展開し、7-AAD染色陰性の細胞群を選抜する(紫:生細胞群ゲート[図2C])。
*7-AADで染色していない単一細胞試料を同一設定のフローサイトメーターで事前に展開し、非染色細胞を定義する閾値を設定しておく([図2C] 赤破線)。
- 生細胞群ゲート内の細胞について、X軸をGFP蛍光のパルス面積(GFP-A)、Y軸を細胞数(Count)としてヒストグラムで表示する[図2D]。GFP蛍光陽性の細胞群とGFP蛍光陰性の細胞群に分類する [図2D]。
*GFPを発現しない単一細胞試料を同一設定のフローサイトメーターで事前に展開し、GFP蛍光陰性細胞を定義する閾値を設定しておく([図2D] 赤破線)。
7. GFPを発現する生細胞のソーティング
- 低流速の条件でフローサイトメトリーを行い、図2DのGFP蛍光陽性と判断された細胞集団を「GFPを発現した単一の生細胞」として、チューブ内の血清含有培地に取得する。
- 取得した細胞の懸濁液を遠心分離し、得られた細胞ペレットを血清含有培地で再懸濁する。
- 得られた細胞懸濁液を培養プレート等に播種し、恒温機内に速やかに移して培養する(GFP発現細胞の純培養)。
*フローサイトメトリーの流速(流路圧)が高すぎると、生細胞がソーティングを経て損傷し、結果として、 7-AAD 陰性の生細胞として回収されながら、回収液中では既に死細胞となってしまうことがある。(損傷のために実は死んでいる= 7AAD 判断の後に死細胞となった)
→ ソーティングで得られた細胞を再度フローサイトメトリー解析することで、GFP発現細胞として取得した細胞集団の純度と生存率を評価することができる。
セルソーティングは、GFP発現細胞に限らず、他の蛍光タンパク質レポーターを発現する細胞や、蛍光標識抗体または蛍光染色剤で染色されたあらゆる細胞を対象に行うことができ、汎用性が高い分離・回収技術です。さあ、目的の細胞を特異的に蛍光染色し、細胞集団の中から単一細胞ソーティングしてみましょう。
関連記事Recommend
-

ネコの行動研究で博士号!美大出身編集者が社会人博士課程で学位と同時に得たものは?
-

企業研究者、大学教授、そして母として──メニコン・伊藤恵利さんに聞く“多面的キャリアを切り拓く秘訣”とは?
-

家族との時間も研究も無理なく楽しむ。世界で初めて円石藻「ビゲロイ」の培養に成功し「サイエンス」の表紙を飾るまで(高知大学 海洋コア国際研究所 萩野恭子先生)
-

「継続することの大切さを教えてくれる理系の名言・エピソード」(リケラボまとめ)
-

「研究に迷ったときヒントになる理系の名言」(リケラボまとめ)
-

【動画解説】夏の強敵 “蚊に刺されやすい人”にはある共通点があった・・・!
-

植物と虫の“匂い”を通じた会話を探究する生態学者、塩尻教授の「人生を変えた私の5冊」
博士の本棚(第12回)│龍谷大学 塩尻かおりさん
-

フローサイトメトリー(3/5) 細胞試料中に存在する生細胞と死細胞を計数するために
リケラボ実験レシピシリーズ
-

進化する生命科学の探究者、真下教授の「人生を変えた私の5冊」
博士の本棚(第11回)│東京大学 真下知士さん
-

フローサイトメトリー(2/5) プロトコル編
リケラボ実験レシピシリーズ