化学実験、バイオ実験のノウハウなど、毎日の実験・分析に役立つ情報をお届け。

原理と背景
前項までに、試料中の細胞ひとつひとつについて、形態の特徴や機能を解析できる技術として、フローサイトメトリーをご紹介しました。フローサイトメトリーを用いると、試料中に生きている細胞と死んだ細胞がそれぞれどのような個数・割合で存在するのかを明らかにすることができます。また、その死細胞の形態の特徴を調べ、その細胞死を分類することもできます。
細胞の死として代表的なものに、細胞が損傷したり、細胞に有害物が蓄積することで引き起こされる壊死(ネクローシス)があります。これとは対照的に、厳密にプログラムされた自死であるアポトーシスがあります。アポトーシスは、多細胞生物の発生に欠かせない生命現象で、その異常は形態形成不全(奇形)、さらにはがんや自己免疫疾患の発症につながることがあります。これらの似て非なる2種の細胞死、アポトーシスとネクローシスは、その制御に関わる分子の種類やメカニズムが異なることが知られています。そのため、例えば、がん細胞に死を誘導する薬剤を探索・開発するがんの創薬研究では、候補薬で処理された細胞にどのような細胞死がどの程度生じたかを計測する技術は不可欠となり、その結果は抗がん薬効作用の分子メカニズムを理解する重要な手がかりにもなります。
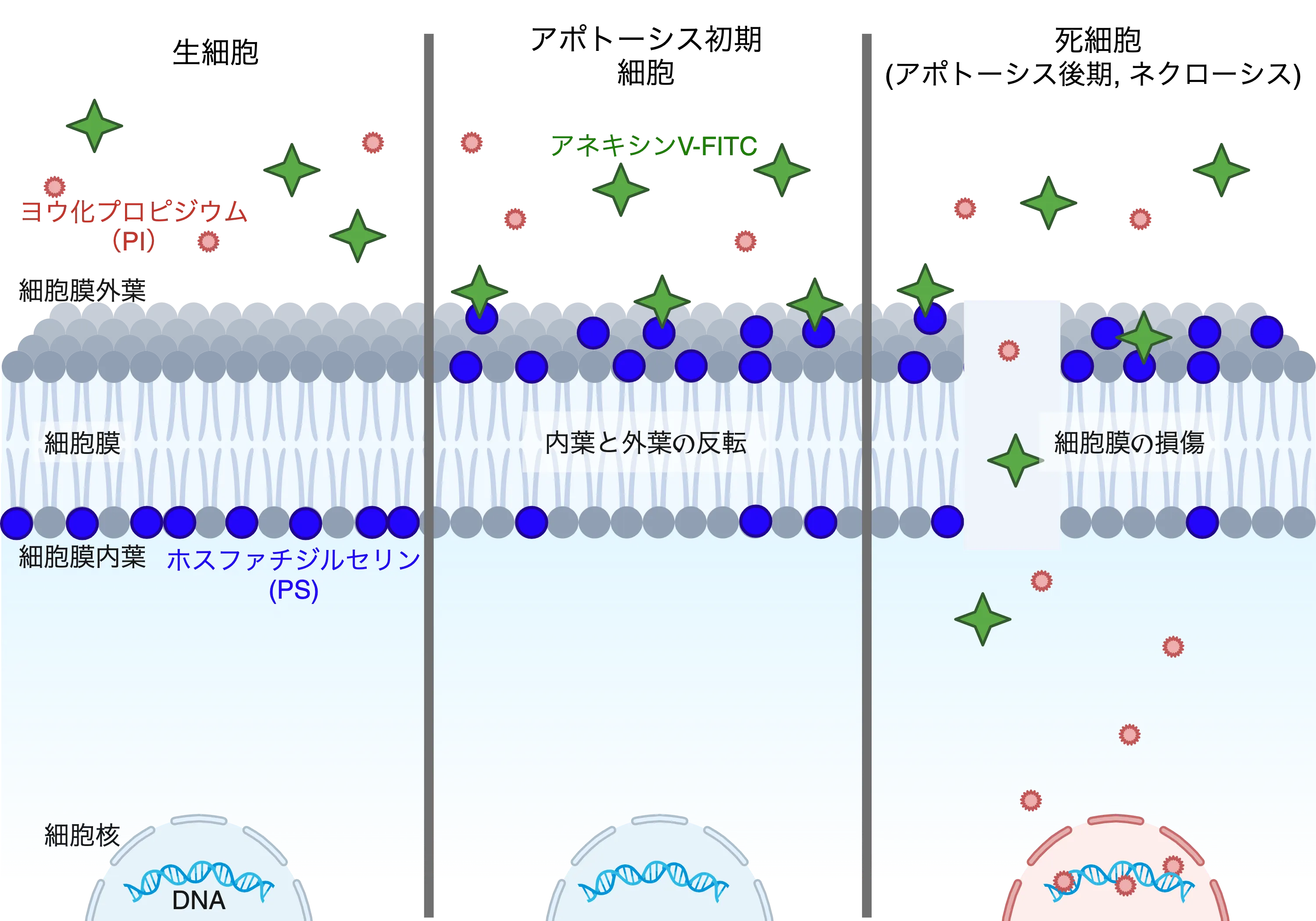
生きている正常な細胞では、細胞の内側(内葉:細胞質側)と外側(外葉:細胞表面側)で、細胞膜に分布する脂質分子の種類が異なります。例えば、ホスファチジルセリン(PS)は生細胞では内側に存在し、外側には存在しません。一方、アポトーシスの初期の細胞の細胞膜は、穴などの損傷がない点は生細胞と同様ですが、内側に保持されていたPSが外側に反転し、細胞外に露出することが知られています。これらのアポトーシス細胞は、後期を迎えると細胞膜が損傷する特徴をもちます。対照的にネクローシスの死細胞では、早期から細胞膜の損傷が始まります。[図1]。したがって、アポトーシスに特徴的な初期の状態に着目することで、アポトーシス細胞をネクローシス細胞と区別して観察することができます。
「細胞膜の損傷が無い細胞でPSが外側にある=アポトーシス初期」なので、次のようなものを利用することもできます。PSに結合するアネキシンVというタンパク質に蛍光分子FITCを結合したアネキシンV-FITCを用いることで、PSが細胞表面に露出したアポトーシス初期細胞を蛍光標識することができます。
また、DNAに結合する細胞核染色剤、ヨウ化プロピジウム(PI)は、細胞膜を透過することができないため、細胞膜に損傷のない生細胞の核は染色できません。対照的に、細胞膜に損傷がある(細胞膜に穴がある)とPIが細胞内に入り込めるようになるため、アポトーシス後期の細胞やネクローシスの死細胞は、PIによって核が蛍光染色されます。[図1]
では、これらの原理をもとに、一例として「市販のキットを用いたフローサイトメトリーによる細胞の生死解析」をしてみましょう。
*参照:Annexin V-FITC Appotosis Assay Kit, ImmunoChemistry Technology社
必要な試薬と材料
- アネキシンV-FITC (200x):励起波長: 494nm, 蛍光波長: 519nm
- 10x 結合バッファー(アネキシンVとPSの結合に不可欠なカルシウムを含有)
- ヨウ化プロピジウム(PI) (250μg/mL):励起波長: 536nm, 蛍光波長: 617nm
- 純水
- リン酸緩衝生理食塩水(PBS) pH 7.4
- 培養細胞の懸濁液
- 細胞膜損傷の誘導薬:3%ホルムアルデヒドを含むPBS
- 血球計算板
- 遠心分離機(200xg)
- 15mL プラスチック遠心管 (1本/sample)
- フローサイトメトリー用プラスチック試験管
実験手順
1. 細胞試料の調製
- 通常の培養環境で調製した対照群の細胞と実験群の細胞を用意する。細胞密度が高過ぎるまたは低過ぎると、対照細胞でもアポトーシスが誘導されてしまうので注意。
- 対照群の細胞は、手順4で述べるフローサイトメーターの設定にも別途必要。
2. 試薬の調製
- 1x結合バッファーの調製:
→ 10x結合バッファーを純水で10倍に希釈して、1x結合バッファーを作り、氷上に置く。 - 20xアネキシンV-FITC溶液の調製:
→ 200xアネキシンV-FITC溶液をPBSで10倍に希釈する。染色を行う直前に調製する。 - 20x PI染色溶液の調製:
→ 50μg/mL のPI試薬をPBSを溶媒として、染色を行う直前に調製する。
3. 細胞の染色
- 対照群の細胞ならびに実験群の細胞を用意する。
- それぞれの細胞を15mLチューブに回収し、氷冷したPBSで細胞を洗浄する。
- 200xgで10分間の遠心分離を行い、細胞のペレットを得る(培養液中に混在するPSが露出した細胞破片を除去するため)。
- 氷冷した1x結合バッファーに、細胞を50万~100万個/mLの濃度で再懸濁し、そのうち約100μLを細胞試料として分注する。
- 20xアネキシンV-FITC液(5μL)と20xPI染色液(5μL)を、調製した約100μLの試料に加えて、氷上の暗所で10分間インキュベートする。
- 試料チューブに1x結合バッファー(250μL)を加えて細胞試料を希釈する。
- 5分以内にフローサイトメーターで解析する。PIは細胞に対して弱い毒性があるため、細胞試料は常に氷冷し、1時間以内に解析を終える。PI染色後にできるだけ早く解析を行うことで偽陽性を防ぐことができる。
4. フローサイトメーター測定の準備
●解析対象となる実験群の細胞およびその対照細胞とは別に、調整用細胞を用意し、フローサイトメーターの補正とゲート設定
調整用細胞:
→細胞膜を人為的に損傷させることで、アネキシンV-FITCとPIの両方に染色性をもつ細胞試料。対照群の細胞を氷上で3%ホルムアルデヒドを含むPBSで30分間処理することで調製する。洗浄後に、氷冷した1x結合バッファーに再懸濁して用いる。
●下記の4種の「染色済みの調整用細胞」を調製する。
a. 未染色の調整用細胞 (アネキシン -, PI -)
b. アネキシンV-FITCで単独染色した調整用細胞 (アネキシン +, PI -)
c. PIで単独染色した調整用細胞 (アネキシン -, PI +)
d. アネキシンV-FITCとPIで二重染色した調整用細胞 (アネキシン +, PI +)
●励起光学系と検出光学系の選択
励起光学系:アネキシンV-FITCとPIはいずれも488nmの青色光で励起する。
検出光学系1:FITCから生じる蛍光は、530/30フィルター(FL1検出器)で検出する(FITCチャネル)。
検出光学系2:PIから生じる蛍光は、670LPフィルター(FL3検出器)で検出する(PIチャネル)。
5. フローサイトメトリー測定と解析
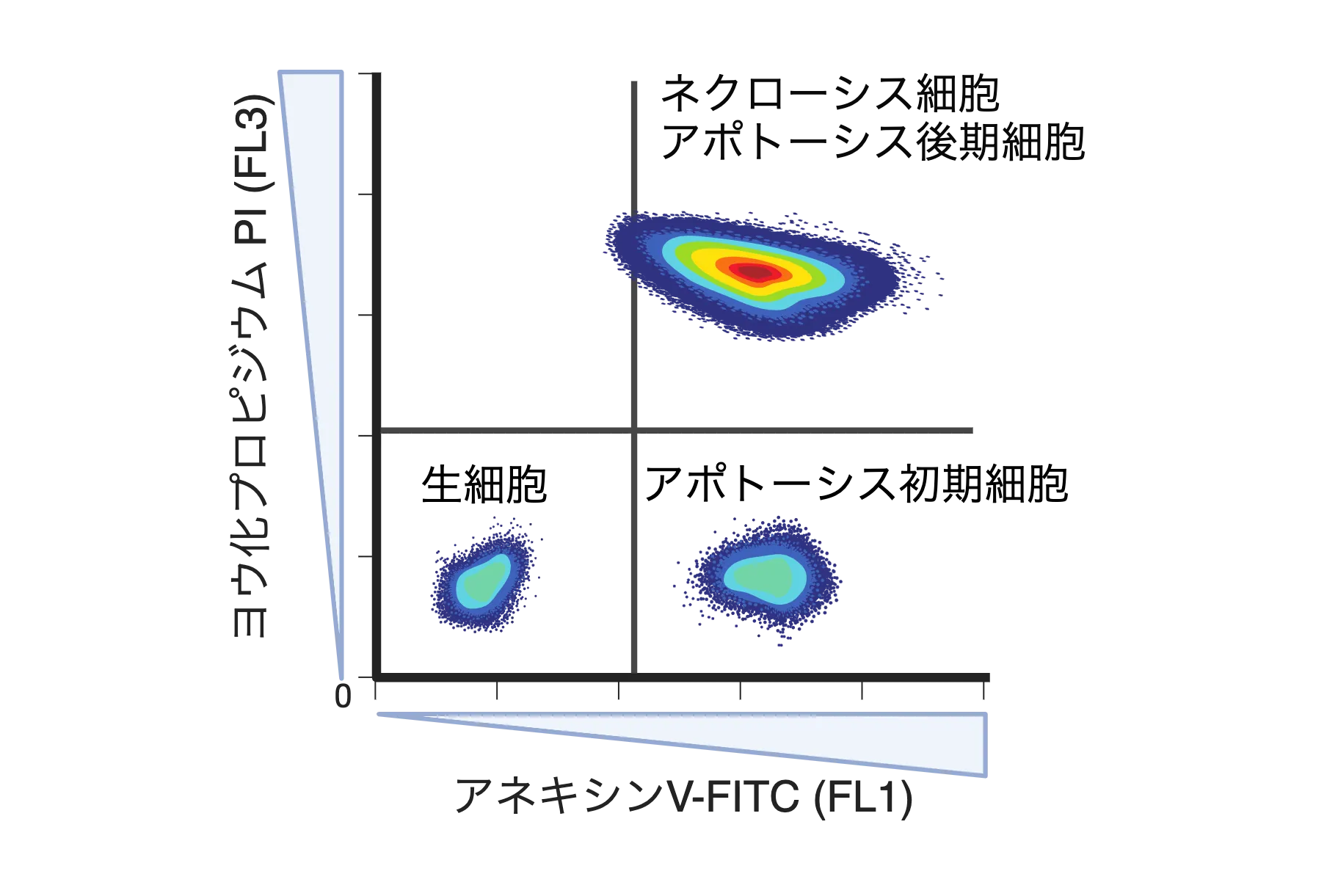
- 未染色の調整用細胞(上記a)をフローサイトメーターに流します。この未染色細胞の単一細胞が、FL1-FL3ドットプロットの最小値側で表示されるように電圧値調整とゲート作成を行います。[図2]
- 蛍光検出補正(コンペンセーション)注1:波長が異なる2種の蛍光をそれぞれ正確に計測するために行います。漏れ込み蛍光量の減算処理。
単独染色した調整用細胞(上記b,c)と二重染色した調整用細胞(上記d)をそれぞれフローサイトメーターに流します。それぞれの単独染色細胞の平均蛍光強度と、二重染色細胞の対応する蛍光の平均強度が同等値になるように補正します。[図2]
→ FITCとPIの染色性の有無を両軸とした、4象限注2からなるFL1-FL3ドットプロットを作成します。以降、どの象限に検出されたかによって、その細胞のFITCとPIの染色性を明らかにすることができます。 - 対照群の細胞をフローサイトメーターに流し、アネキシンV-FITCとPIに対する染色性の有無と程度を明らかにします。
- 実験群の細胞をフローサイトメーターに流して、染色性の有無と程度を明らかにし、対照群の細胞と比較します。
- アネキシンV-FITCとPIによる細胞染色結果から、その細胞の生死の状況や、細胞死の特徴・種別を明らかにします。[図2][表1]
*注1:FITCの蛍光スペクトルとPIの蛍光スペクトルは部分的に重なるため、PI蛍光の検出器(PIチャネル)にFITC蛍光が一部漏れ込んで検出されてしまいます。つまり、意図しない蛍光が加算されて、純粋なPI蛍光が上振れすることになります。PI蛍光の量(強度)を正確に測定するためには、PIチャネルで取得した総蛍光量から、漏れこんだFITC蛍光の分を減算する(差し引く)補正が必要です。
適切に補正された蛍光検出条件では、アネキシンV-FITCとPIの二重染色(調整用細胞d)とPI染色のみの細胞(c)でPIチャネルだけの側面からみた場合の蛍光強度の平均が同等の値になります。同様に、逆方向(PI蛍光のFITCチャネルへ)の漏れ込みの有無も事前に確認し、PI染色が陽性の細胞(d)と陰性の細胞(b)の間でFITCチャネルで検出される蛍光強度の平均値が同等であることを確認します。
用語解説
*注2:4象限とは、FITCおよびPIの陽性・陰性の組み合わせによる4領域のことを指します。
この解析系を用いることで、細胞試料中にどのくらいの頻度で、どのような細胞死が生じているかを計測することができます。さらに、フローサイトメトリーのゲート解析技術を組み合わせると、試料中の特定の細胞集団(生細胞のみなど)を任意に選択して、その形態や機能を調べることもできます。例えば、PIなどに代表される細胞核の染色剤を用いることで、細胞核の形態やDNA量も計測でき、その細胞の細胞周期の状態を明らかにすることもできます。ということで、次項ではフローサイトメトリーを用いた細胞周期解析を紹介していきます。
*監修
パーソルテンプスタッフ株式会社
研究開発事業本部(Chall-edge/チャレッジ)
研修講師(理学博士)
この記事は、理系研究職の方のキャリア支援を行うパーソルテンプスタッフ研究開発事業本部(Chall-edge/チャレッジ)がお届けする、実験ノウハウシリーズです。
過去の記事一覧:実験レシピシリーズ
関連記事Recommend
-

フローサイトメトリー(5/5) フローサイトメトリーを用いたセルソーティング
リケラボ実験レシピシリーズ
-

ネコの行動研究で博士号!美大出身編集者が社会人博士課程で学位と同時に得たものは?
-

企業研究者、大学教授、そして母として──メニコン・伊藤恵利さんに聞く“多面的キャリアを切り拓く秘訣”とは?
-

家族との時間も研究も無理なく楽しむ。世界で初めて円石藻「ビゲロイ」の培養に成功し「サイエンス」の表紙を飾るまで(高知大学 海洋コア国際研究所 萩野恭子先生)
-

「継続することの大切さを教えてくれる理系の名言・エピソード」(リケラボまとめ)
-

「研究に迷ったときヒントになる理系の名言」(リケラボまとめ)
-

フローサイトメトリー(4/5) フローサイトメトリーを用いた細胞周期の解析
リケラボ実験レシピシリーズ
-

【動画解説】夏の強敵 “蚊に刺されやすい人”にはある共通点があった・・・!
-

植物と虫の“匂い”を通じた会話を探究する生態学者、塩尻教授の「人生を変えた私の5冊」
博士の本棚(第12回)│龍谷大学 塩尻かおりさん
-

進化する生命科学の探究者、真下教授の「人生を変えた私の5冊」
博士の本棚(第11回)│東京大学 真下知士さん