化学実験、バイオ実験のノウハウなど、毎日の実験・分析に役立つ情報をお届け。

はじめに
「PCR」の開発によって、生命の遺伝情報の本体である核酸(DNA・RNA)を自在に増幅・改変・解析することができるようになりました。例えば、A(アデニン),G(グアニン),C(シトシン),T(チミン)の4種類の塩基の組み合わせからなる遺伝情報を”A/G/C/Tから構成されるデジタル情報”として読み解く、DNA配列解析法(DNAシーケンシング)も、PCRをもとに開発された技術として広く用いられています。本項では、数多くのPCRの応用例の中から、「部位選択的な遺伝子変異の導入法」についてご紹介します。
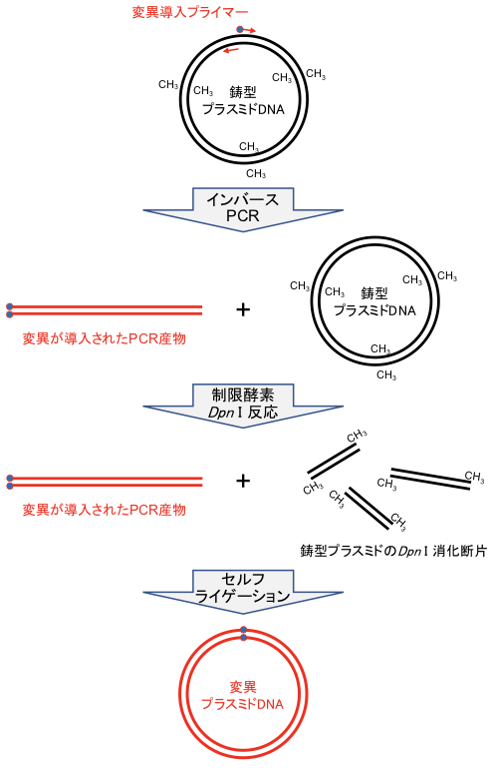
一般的なPCRでは、ペアとなるプライマーを互いに向き合うように(内向きに)アニールさせ、両プライマーに挟まれたDNA領域の増幅を行います。一方で、本項の遺伝子変異導入法では、ペアとなるプライマーを逆方向(外向き)にアニールさせて伸長反応を行う応用的なPCRである「インバースPCR」が用いられます[図]。
従来の主流であった変異原性の化学物質などを用いたランダム変異導入法とは対照的に、PCRを応用した部位選択的変異導入法(site-directed mutagenesis)では、変異導入部位の選択や変異配列の設計を任意に行うことができます。この優れた利便性から、部位選択的変異導入は、変異型タンパク質の作製や機能解析、タンパク質へのアミノ酸配列の付加、プロモーターやシスエレメントの機能解析など生命科学の広範な用途に利用されています。
さあ、ここで「インバースPCRによる部位選択的変異導入」のノウハウを学び、自在に遺伝子を改変できる技術を身につけましょう。
部位選択的変異導入実験のプロトコール
以下の実験操作1~4を順に進めることで、任意の変異が導入されたプラスミドDNAを、大腸菌クローンとして得ることができます。
- 変異導入プライマーの作製
- 変異導入プライマーを用いた鋳型プラスミドのインバースPCR
- 制限酵素Dpn I による鋳型プラスミドの消化
- PCR産物のセルフライゲーション
- 環状化したPCR産物を用いた大腸菌の形質転換
では、各手順の詳細を順にご紹介します。
1.変異導入プライマーの作製
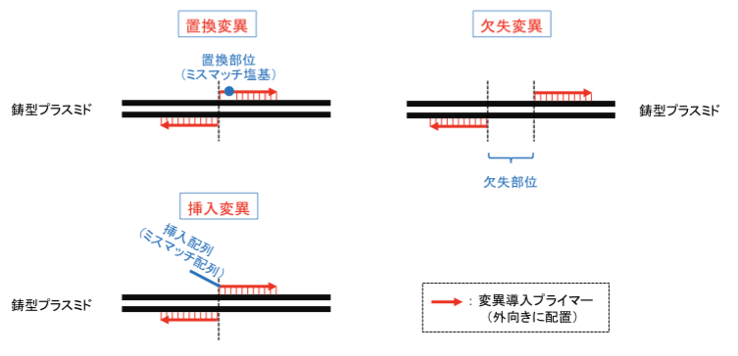
インバースPCRでは、プライマーの設計の仕方によって、それぞれ「置換変異」、「挿入変異」、「欠失変異」を導入することができます。
1-1.「置換変異」および「挿入変異」を導入する変異プライマーの設計
- プライマーの5’末端あるいは5’末端付近に、「置換変異」または「挿入変異」をもつミスマッチ配列を配置する。
- プライマーの3’端側に、鋳型DNAと相補的な配列を持つ、25塩基対以上のアニール部位を配置する。
- 「置換変異」:1〜6塩基程度の置換の場合には、効率良い変異導入が期待できる。
- 「挿入変異」:タグ配列など、10アミノ酸程度のペプチドをコードする30塩基対程度のDNA断片の挿入に用いられることが多い。
1-2.「欠失変異」を導入するプライマーの設計
- 欠失したい領域(欠失部位)が、PCRによって増幅されないようにプライマーを設計する。プライマーのアニール部位を、欠失部位より下流(3’端側)に配置する。
2.変異導入プライマーによる鋳型プラスミドのインバースPCR
上記の変異導入プライマーを使って、プラスミドDNAを鋳型としたインバースPCRを行います。ここでは、KOD-Plus-Neo DNAポリメラーゼ(東洋紡)を使用したPCR反応の例をご紹介します。
変異を導入する際に行うインバースPCRでは、プルーフリーディング(校正)活性を持つ、高正確性のDNAポリメラーゼを用います。これにより、目的の変異導入箇所以外の部位に偶発的にエラー/変異が入るのを防ぎます。また、校正活性をもつポリメラーゼは平滑末端のPCR産物を産生するため、PCR産物のセルフライーゲーションが可能になります。
*Taqポリメラーゼは、3’末端にアデニン(A)が付加された突出末端を産生するため、本実験には不適です。
3.制限酵素Dpn I による鋳型プラスミドの消化
PCR反応後のDNA試料をフェノール・クロロホルムとエタノールで精製し、制限酵素Dpn I で処理します。これにより、PCR反応を経て試験管内に残存している鋳型プラスミドを消化します。
Dpn I は、メチル化(CH3)を受けた5’--GATC--3’サイトを認識して切断します。一般的な大腸菌株(コンピテントセル:DH5α, JM109など)から調製したプラスミドは、大腸菌の細胞内でメチル化を受けているため、Dpn I の基質になります。一方で、試験管内で新規に合成されたインバースPCRの産物は、メチル化を受けていないためDpn I の基質になりません。
4.PCR産物のセルフライゲーション
Dpn I 処理によって鋳型プラスミドの切断を終えた試料中には、変異が導入された直鎖状のインバースPCR産物が存在します。次に、この変異PCR産物のセルフライゲーション(分子内自己環状化)を行います。
ライゲーション反応を効率良く進めるために、その基質となるPCR産物の末端部をリン酸化します。
*ここでは、T4ポリヌクレオチドキナーゼを用いたリン酸化反応を、LigationHigh(東洋紡)を用いたライゲーション反応と同時に進めるプロトコールをご紹介します。
5.環状化したPCR産物を用いた大腸菌の形質転換
セルフライゲーション産物(約5μl)を用いて、環状化変異プラスミドによる大腸菌の形質転換(トランスフォーメーション)を行います。
形質転換によって得られた大腸菌クローンからプラスミドDNAを精製します[プラスミドDNAの精製参照]。
アガロース電気泳動[アガロース電気泳動参照]やDNAシーケンサーを用いた配列解析などによって変異の導入が確認できたら、本実験の成功となります!
*監修
パーソルテンプスタッフ株式会社
研究開発事業本部(Chall-edge/チャレッジ)
研修講師(理学博士)
この記事は、理系研究職の方のキャリア支援を行うパーソルテンプスタッフ研究開発事業本部(Chall-edge/チャレッジ)がお届けする、実験ノウハウシリーズです。
過去の記事一覧:実験レシピシリーズ
関連記事Recommend
-

フローサイトメトリー(5/5) フローサイトメトリーを用いたセルソーティング
リケラボ実験レシピシリーズ
-

フローサイトメトリー(4/5) フローサイトメトリーを用いた細胞周期の解析
リケラボ実験レシピシリーズ
-

フローサイトメトリー(3/5) 細胞試料中に存在する生細胞と死細胞を計数するために
リケラボ実験レシピシリーズ
-

フローサイトメトリー(2/5) プロトコル編
リケラボ実験レシピシリーズ
-

フローサイトメトリー(1/5)概要と原理編
リケラボ実験レシピシリーズ
-

細胞の免疫蛍光染色 実践編(2/2)
リケラボ実験レシピシリーズ
-

細胞の免疫蛍光染色 基本編(1/2)
リケラボ実験レシピシリーズ
-

細胞内でRNA干渉を人為的に誘導するために RNA干渉による遺伝子発現の調節(2/2)
リケラボ実験レシピシリーズ
-

RNA干渉(RNA interfering, RNAi)とは? RNA干渉による遺伝子発現の調節(1/2)
リケラボ実験レシピシリーズ
-

免疫沈降法(Immunoprecipitation)による目的タンパク質の濃縮 基本から応用まで
リケラボ実験レシピシリーズ