化学実験、バイオ実験のノウハウなど、毎日の実験・分析に役立つ情報をお届け。

「EDTA」
生物実験でも化学実験でもよく耳にするこの名前、
正式名称はEthylenediaminetetraacetic acidです。
使用頻度の高い溶液ですので、ラボテクニシャンがまとめてストックを作るラボも多いと思います。しばしば入試に出ることがあるので必死で覚えた読者もいるのではないでしょうか。
このEDTA、きわめて優秀な金属イオン(2価)のキレート剤として有名です。
キレートとは「錯体」と呼ばれる結合状態を金属イオンとの間で作ることで金属イオンをあたかもEDTA内に吸収してしまう状態を指します(キレートの語源はラテン語で蟹のはさみ)。つまり、EDTAは溶液中の金属イオンを根こそぎ奪っていく性質をもっているのです。
一方、生物が生きていくためには金属イオンが必要なことが知られていて、いくつかの酵素では金属イオンが不足すると働かないことから、このキレート効果で酵素を不活化(働かなく)させることもできます。たとえば、DNAの電気泳動バッファーにEDTAが入っているのもDNA分解酵素を不活化させるためといわれています。細胞破砕バッファーなんかにもEDTAが入っていることも同様な理由からです。ちなみに、よく似た名前のEGTAはカルシウムイオンを選択的にキレートします。
☆
さて、EDTAのストック溶液を作るときに「溶けない」ことで、立ち往生したことはありませんか。EDTAを溶かしていくとpHが酸性になり徐々に溶けなくなります。
なぜでしょうか?
先ほど、EDTAの正式名称を紹介しましたが「-tetraacetic acid」とあります。これは四酢酸を意味しますので、EDTAは弱いですが酸の性質をもっています。このため、溶液が酸性になると酸として働けなくなり、水(極性溶媒)には溶けにくくなると考えられています(水と油の関係と同じです)。
必要試薬
・エチレン次アミン四酢酸二ナトリウム水和物
(EDTA2Na・2H2O、分子量=372.24)
0.5Lのストック溶液を作る場合の必要量です。
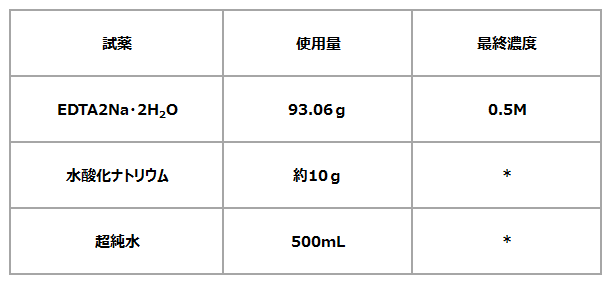
調整方法
① EDTA粉末を超純水400mLに入れ撹拌
② 水酸化ナトリウムを少しずつ入れpHを測定
③ 完全に溶解したところで、pHを8.0に合わせ500mLにメスアップ
④ 必要であれば、オートクレーブ滅菌を行い、室温にて保存
*このシリーズは、パーソルテンプスタッフ株式会社 研究開発事業本部の研修講師(理学博士)による試薬調整法の解説です。
*Chall-edge(チャレッジ)では、実験・分析に関わる研修を随時開催しております。
詳しくはこちら
化学実験トレーニング・HPLC研修・リアルタイムPCR・細胞培養研修(受講無料)
関連記事Recommend
-

フローサイトメトリー(5/5) フローサイトメトリーを用いたセルソーティング
リケラボ実験レシピシリーズ
-

フローサイトメトリー(4/5) フローサイトメトリーを用いた細胞周期の解析
リケラボ実験レシピシリーズ
-

フローサイトメトリー(3/5) 細胞試料中に存在する生細胞と死細胞を計数するために
リケラボ実験レシピシリーズ
-

フローサイトメトリー(2/5) プロトコル編
リケラボ実験レシピシリーズ
-

フローサイトメトリー(1/5)概要と原理編
リケラボ実験レシピシリーズ
-

細胞の免疫蛍光染色 実践編(2/2)
リケラボ実験レシピシリーズ
-

細胞の免疫蛍光染色 基本編(1/2)
リケラボ実験レシピシリーズ
-

細胞内でRNA干渉を人為的に誘導するために RNA干渉による遺伝子発現の調節(2/2)
リケラボ実験レシピシリーズ
-

RNA干渉(RNA interfering, RNAi)とは? RNA干渉による遺伝子発現の調節(1/2)
リケラボ実験レシピシリーズ
-

免疫沈降法(Immunoprecipitation)による目的タンパク質の濃縮 基本から応用まで
リケラボ実験レシピシリーズ



