リケラボは研究者、研究開発・技術職など理系の知識を生かしてはたらきたい人を応援する情報サイトです。

2020年のノーベル化学賞は、2人の女性研究者に贈られました。対象となったのは、ゲノム編集の新手法「CRISPR-Cas9(クリスパー・キャス9)」です。ただ画期的と評された技術ながら、特に医療面での応用はまだまだ進んでいないのが実状です。
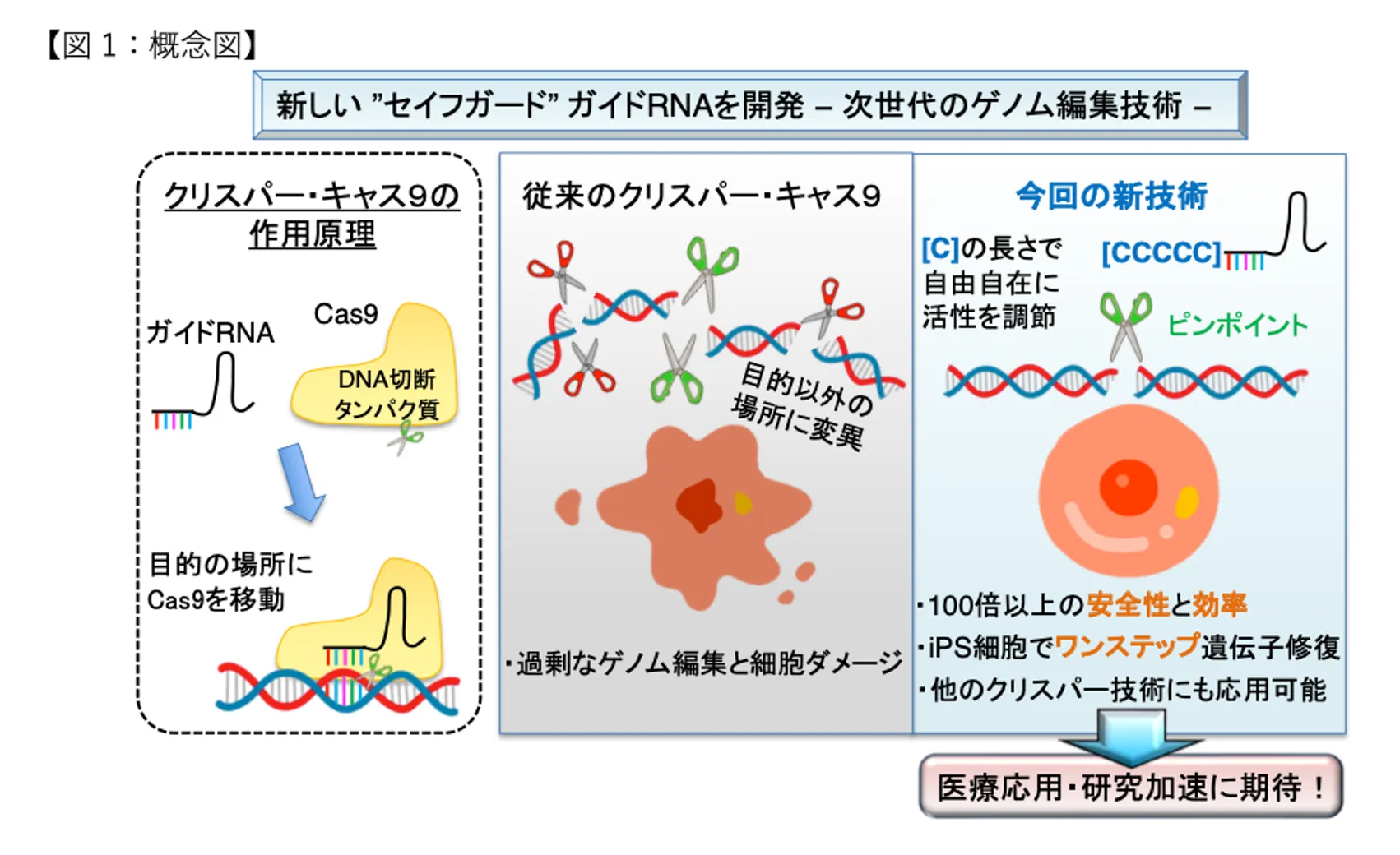
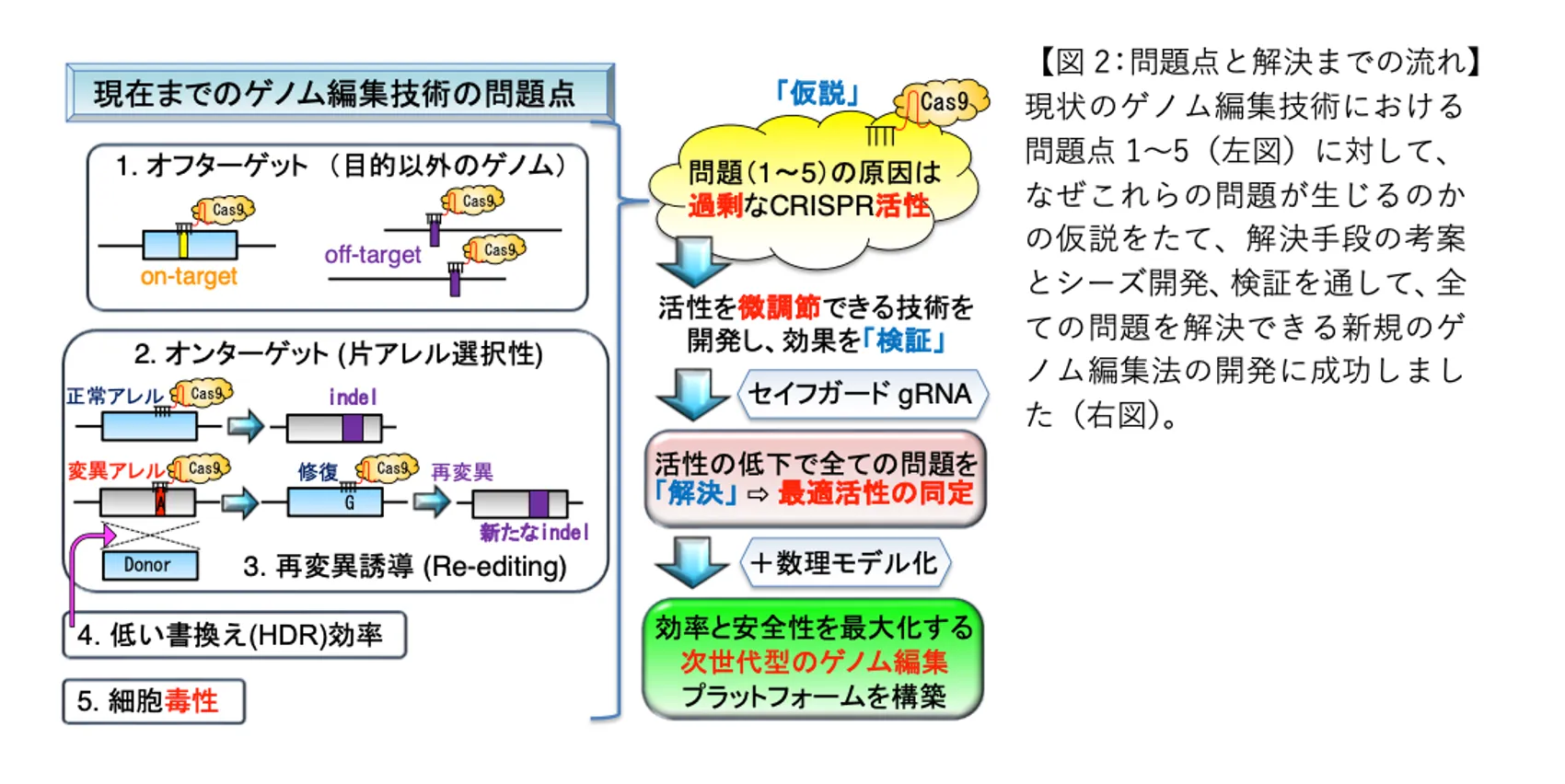
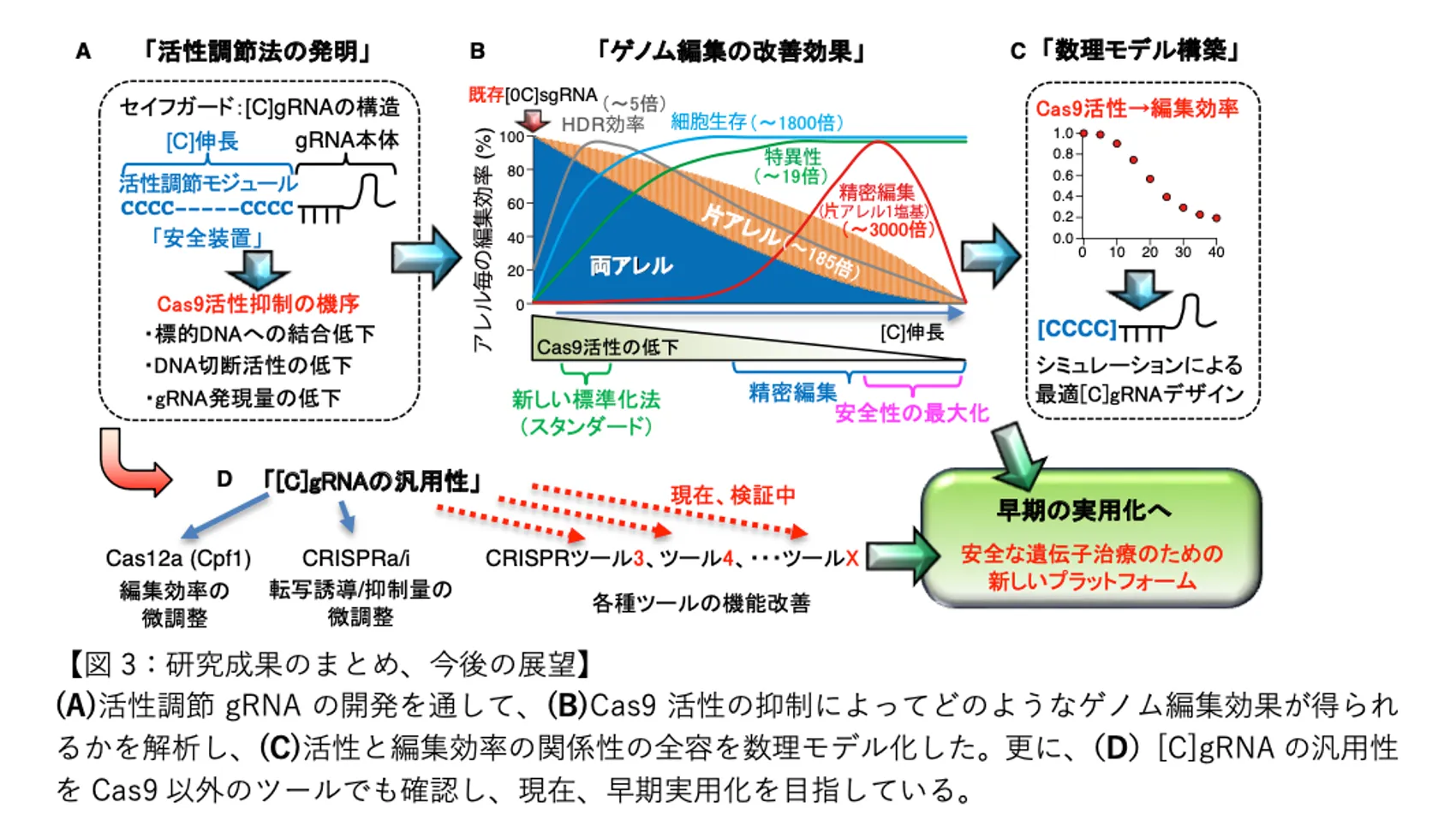
普及に至らない原因のひとつは、ゲノム編集の精度にあります。現状では精緻な編集をできないため、目的以外の部位を編集するなどのリスクを回避できないのです。この問題解決に取り組んだ九州大学生体防御医学研究所の川又理樹助教らは、編集精度を100倍以上向上させ、安全性も高める技術「セイフガードgRNA」を開発しました(※)。画期的な技術革新により安全な遺伝子治療の実用化が、視野に入ってきています。遺伝子疾患に悩む人たちを一刻も早く救いたいと、川又助教らはアメリカでベンチャーを起業。今後は、ゲノム編集の医療適用をめざす企業との連携を進める計画です。
※https://www.nature.com/articles/s41551-023-01011-7
始まりは、CRISPR-Cas9に対する素朴な疑問から
── CRISPR-Cas9が発明されたごく初期から、この技術を使っていたそうですね。
川又:ノーベル賞受賞者の女性研究者2人(微生物学者のエマニュエル・シャルパンティエ(Emmanuelle Marie Charpentier)教授と生化学者のジェニファー・ダウドナ(Jennifer Anne Doudna)教授)が、論文発表したのが2012年です。続いて2013年には、MITのラボに所属していたフェン・ジャン(Feng Zhang)教授が、CRISPR-Cas9を使って哺乳類細胞でのゲノム編集に成功しました。私がMITのあるボストンに留学に行ったのが、ちょうどその頃です。留学先のボス、フェルナンド・カマルゴ(Fernando Camargo)博士が、肝臓の遺伝子治療に取り組みたいと考え、それならCRISPR-Cas9を試してみようと思いついた。そこで日本でもゲノム編集に携わっていた私に、研究プロジェクトを立ち上げてくれという話になったのです。早速フェン・ジャン教授のラボに材料をもらいに行き、CRISPR-Cas9を活用する実験系を立ち上げました。
── 留学していきなり最先端の技術を使うというのは、かなりハードなリクエストだと思いますが、戸惑いなどはなかったのでしょうか。
川又:幸い、ゲノム編集には慣れていたので大丈夫でした。留学前の国立がん研究センターでも、ゲノム編集を活用した肝臓の再生医療に携わっていましたし、DNAの組み換え自体は、学生時代から取り組んでいたテーマです。CRISPR-Cas9は第3世代で最新のゲノム編集技術ですが、がんセンターでは第1世代の編集技術であるZFN(ジンクフィンガーヌクレアーゼ)を使っていました。CRISPR-Cas9は、Cas9(キャス9)と呼ばれるDNAを切断する酵素と、この酵素をDNAの特定の部分に導くガイドRNAを組み合わせた技術です。以前からゲノム編集の経験があったので、CRISPR-Cas9が本当に狙ったところだけ編集できるのかと興味津々でした。
── ではボストンでの研究も順調に進んだ?
川又:そうですね。まず所属先の小児病院から、先天性遺伝性肝臓疾患の検体を入手しました。この検体を試験管内で培養します。疾患の原因は遺伝子の突然変異ですから、変異している部分を狙ってCRISPR-Cas9によるゲノム編集を試してみました。結果は成功で遺伝子解析をしてみると、たしかに治っています。ただし、おかしな変化にも気づいたのです。
ちょっとした変異を見逃さず新たな発見に
── おかしな変化とは何だったのでしょうか。
川又:対象とした疾患は、母親由来の染色体上にある遺伝子に変異が起こっているために発症します。だからゲノム編集の対象は母親由来の染色体にある遺伝子で、編集そのものはうまくいきました。ところが念のため、母親由来の染色体と対になる父親由来の染色体の遺伝子を調べてみると、母親の遺伝子編集をしたのと同じ部分に予期せぬ変異が入っていたのです。要するに片側の染色体上の遺伝子の特定部分に編集を加えると、もう片側の染色体の同じ標的部分にも不要な編集が加えられてしまう。もっとも、この肝臓疾患については治療は成功したし、父親由来の染色体に変異が入ったけれども特に悪影響はありません。だから問題ないともいえるのですが、研究者として意図していない変異は気にはなります。
── ボストンでのボスも、川又さんと同じように問題を認識していた?
川又:ボスは何よりもゲノム編集による、治療の成功を評価してくれました。肝臓の機能として治ったんだから、それでグッジョブじゃないかと。しかし私は、いずれ、より精緻な遺伝子治療が求められるようになるはずで、そうなると狙っていない方の染色体にも変異が入るのは問題になると思っていました。その頃、別の実験をしていてもう1つ気づきがありました。CRISPR-Cas9でゲノム編集を行う際には、狙った場所への案内役としてガイドRNAを使います。ところが、あるときガイドRNAを間違って設計してしまったのです。このミスに気づかずにゲノム編集をすると、片方の染色体にしか変異が入らなかった。肝臓疾患のゲノム編集をしたときには、両方の染色体の遺伝子に変異が入ったのに、なぜこのような結果になったのか。原因を調べた結果、わずか1塩基分だけガイドRNAの設計を間違っていたのです。とはいえ狙った部分の編集はできているから、特に問題ではない。けれども間違ったために編集活性が落ちた。狙っていない方の染色体の遺伝子には、何も影響を及ぼさなかったのです。
── 要するにCRISPR-Cas9の編集活性を落とせば、より精密な編集の可能性があるわけですか。
川又:そのとおりです。活性を落とせば、自由自在な精密編集の可能性があると気づきました。CRISPR-Cas9については以前から、活性が強すぎるために標的以外の場所を切ってしまう問題も指摘されていたのです。この問題も解決できるかもしれないとボスに話をしたのですが、私の帰国時期が近づいていたので「マサが日本に戻って、自分のラボを持ってから、ぜひチャレンジしなよ」といってくれた。2015年の話で、その結果がようやく8年後、2023年の4月に出した論文にまとまったというわけです。
── では、帰国してすぐに研究の続きに取りかかったのですね。
川又:ところがそういうわけではなかったのです。帰国後に赴任したのは九州大学でしたが、ここではCRISPR-Cas9の編集技術を使い、肝臓発生に関する研究プロジェクトに参加しました。このときは当然ですが、標準的な設計のガイドRNAでゲノム編集を行ったので、父親由来と母親由来、双方の遺伝子に変異が入ります。この実験に取り組みながらも、なんとかしてCRISPR-Cas9の活性を、思うようにコントロールできないかと考えていました。実際に遺伝子疾患の多くは、母親もしくは父親由来のいずれかの染色体上で起こります。だから疾患治療にCRISPR-Cas9を使うなら、正確に片側だけに作用させたい。この取り組みはプロジェクトの主旨とは外れた内容ですから、こっそりと好奇心の赴くままに追加でいろいろ試していました。
直感を信じてトライしてみた、その結果……
── 要するにCRISPR-Cas9の活性をいかに落とすかが、個人的なテーマだと。
川又:いろいろ試しているうちに、ふと、ガイドRNAにシトシンを付け加えたらどうなる?と閃いたのです。これはもう完全に直感というか、単なる思いつきというべきでしょう。要するにCRISPR-Cas9ではガイドRNAを案内役として、DNAを切断するハサミ役の酵素CRISPR-Cas9を狙ったところに持っていくわけです。であるならガイド役に余計なものをくっつけておけば、ハサミによる切断を邪魔するんじゃないかと思いついたのです。
── DNAを構成する4つの塩基、A(アデニン)・T(チミン)・G(グアニン)・C(シトシン)の内、なぜシトシンだったのでしょう。
川又:CとGの結合は、AとTの結合よりも強いのです。だとすればハサミがDNAと結合したりその後に切る時に強い抑制をするのはCかGなのではないかと、ふわっとした発想が浮かんだのです。ただ、そのとき使っていたシステムは、Gを目印として転写を始める仕組みとしていました。だから、まずCで試してみようと思ったのです。すると、たまたまうまくいった。本当に活性が下がって、狙ったとおりに片側だけを編集できた。もちろん、この結果だけで論文を出しても、当然受け容れられません。他の塩基を使ったらどうなるのか、と尋ねられるに決まっている。だから試してみると、CRISPR-Cas9の活性を効率よく弱めるためには、シトシンしか使えないとわかった。次に付け加えるシトシンの長さによって、活性が変わるのかと試してみると予想したとおりに変化する。この結果を見たときには、ワクワクしましたね。
── そこからさらにデータを集めて、さらには数理モデルの構築にまで進めていったのですね。
川又:次のステップとしては、CRISPR-Cas9の編集対象となるさまざまな遺伝子を対象に、シトシンの個数とCRISPR-Cas9の活性の関係性を数式化するためのデータを取っていきました。データ取得のために繰り返した実験とデータ数は、たぶん数百個に達していたはずです。たとえばある遺伝子を編集する際に、付け加えるシトシンの数を9種類変えて活性の変化をデータ化します。これら大規模実験データと数理モデルを組み合わせて、たとえば1塩基置換などの精密編集から用途に応じたさまざまなゲノム編集について、どの程度のCRISPR-Cas9の活性が最適であるのかを解き明かしました。
── その成果を2023年4月に論文にまとめて発表した。
川又:8年かかってようやく、国際学術誌の『Nature Biomedical Engineering』に掲載されました。CRISPR-Cas9の問題は世界中の研究者が認識していましたから、その安全性や精密さを100倍以上高めたと論文発表すると世界中から注目されます。当然、同じような技術開発に取り組む研究者も出てくるでしょう。だからアメリカや日本など数カ国で特許申請をしています。
なぜ日本ではなく、アメリカでのベンチャー起業を選んだのか
── 開発した技術を実用化するためのベンチャーをアメリカで起業した理由は何でしょうか。
川又:私たちの技術が、あくまでもCRISPR-Cas9を前提としたものだからです。CRISPR-Cas9を巡っては、ノーベル賞を受賞した2人の研究者と、MITのフェン・ジャン教授らのチームとの間で特許を巡る争いが起こっています。実用化にはこのどちらかから特許の使用許諾を得る必要がありますが、そのコストが非常に高額なのです。仮にコストをかけて新たな治療法を開発できたとしても、日本国内で治験を繰り返して実用化するまでにはかなり時間がかかります。一方アメリカはいま、国をあげて遺伝子治療に力を入れているため早く承認される上、アメリカの企業には資金力もあります。アメリカで実用化が進めば、すぐにイギリスでも展開でき、そこからヨーロッパへと広げていけます。
── そのベンチャーではCEOを務めるのですか。
川又:いえ、私の専門はあくまでも研究であり、やりたいのも研究ですから。CEOは、その役割に適した人物に任せています。中国生まれの女性で、京都大学工学部と東京大学の工学研究科で学んだ後に渡米し、MITでMBAを取得、その後アメリカの超大手IT企業に務めたキャリアの持ち主です。そこにもう一人、研究技術とベンチャー起業の両方の目利きをできるタレントとして、以前リケラボで紹介されていた慶応大学の早野元詞さんにも経営チームに加わってもらっています。
── そもそも研究者を志した理由は何だったのでしょう。
川又:病で苦しむ人をなんとかして治してあげたい。これが私の原点です。大学は農学部に進みましたが、大学院を出た後は国立がん研究センターに移籍し、アメリカ留学でも拠点を置いていたのはボストン小児病院です。いわゆる遺伝性の希少疾患は難病であり、今のところ根治できる治療法はほとんどありません。これを何とかして治してあげたいのです。その意味でもアメリカでの起業により、少しでも早く、一人でも多くの人を救えるのではないかと考えています。
── あとに続く人たちに教えていただきたいのですが、博士号取得にはどんな意味があるでしょう。
川又:遊び感覚で生きていけちゃう、これが博士の何よりのよさだと思っています。こんないい方をすると、ふざけているように思われるかもしれませんね。もちろん研究は遊びなんかではありません。けれども、遊んでいるのと同じぐらい、あるいはそれ以上に研究は楽しい。CRISPR-Cas9の活性を落とすなどという試みも、誰かから言われたわけではない。けれども、実現できたらおもしろいんじゃないかと考えて、勝手にやってみた。もちろん与えられた研究課題はきちんとこなしながらですが、思いつきの余分実験をやるには睡眠時間を少し削ればいいのです。そんな実験から今回の技術が生まれた。自分にとっておもしろいテーマに好きなように挑戦できる。これが博士(研究者)というキャリアの何よりのメリットだと思います。
川又 理樹(かわまた まさき)
1979年、栃木県真岡市生まれ。2007年、東北大学農学研究科博士課程修了、博士(農学)。2007年より国立がん研究センターリサーチレジデント、2013年よりハーバード大学Fernando Camargo博士のラボに所属し、ボストン小児病院、ハーバード幹細胞研究所にてResearch Fellow。2016年より九州大学生体防御医学研究所助教。2023年2月25日に、九州大学から出願した新規CRISPR-Cas9ゲノム編集法に関する特許をもとに、アメリカでOne Genomics, Inc.を起業。
(※所属などはすべて掲載当時の情報です。)
関連記事Recommend
-

【睡眠研究】人類に必要なのは冬眠…?冬に起きられない理由【動画で解説】
-

ネコの行動研究で博士号!美大出身編集者が社会人博士課程で学位と同時に得たものは?
-

家族との時間も研究も無理なく楽しむ。世界で初めて円石藻「ビゲロイ」の培養に成功し「サイエンス」の表紙を飾るまで(高知大学 海洋コア国際研究所 萩野恭子先生)
-

動くロボットを食べると、人は何を感じるか? ――可食ロボットとの相互作用を通じ、「生の根源」に迫る:電気通信大学仲田佳弘准教授
-

マウスからニワトリ、さらにターコイズキリフィッシュへ。生命の「時の設計図」解明のため、あえてモデル動物を変えていく荻沼チームリーダーの研究戦略
固定観念を覆すpH応答生物学の確立へ
-

昆虫たちのコミュニケーションを、脳の神経レベルで解析する。聴覚研究を通じて、脳の仕組みに迫る上川内教授
-

【ピタゴラスの雑学】“三平方の定理”は意外なところで生まれていた!現代にも活用?【動画で解説!偉人の証明】
-

【化学の基礎】元素周期表の意外な歴史を動画で解説!
-

“指先で考えるロボットハンド”で生産現場にパラダイムシフトを。近接覚センサを武器に「人間を超えるロボット」実現に挑む
大阪大学基礎工学研究科助教/株式会社Thinker取締役 小山佳祐
-
発光の技術で可視化される生命のダイナミズム。 「光る植物」 が、街の風景と社会を変える!
~大阪大学産業科学研究所 永井健治教授~