高校・大学受験や理系の仕事解説など、中学生・高校生の進路選びに役立つ情報をお届け。

動画を見たり友達と連絡を取り合ったり、スマホは生活に無くてはならないアイテムですね。
今回は、「スマホなどの電気製品がどのようなしくみで動いているか」や、「燃料電池やリチウムイオン電池とはどのようなものか」を説明します。
電気のしくみ
電気製品は、回路に電気を流すことによって動きます。
1794年にイタリア人のボルタが電池を発明して、電気を作り出せることが分かりました。
ちなみに、電圧の単位である“ボルト(V)”はボルタの名前が由来となっています。
そして、「電流は、電池の+極(正極)から-極(負極)へ流れる」と決めました。しかし、当時は実際にどのようなものが流れているかは分かりませんでした。
1826年にドイツのオームによって電流・電圧・抵抗の関係が分かり、オームの法則が発表されて電気の分野は発展していきます。
1897年にイギリスのJ・J・トムソンによって電子が発見されました。電子はマイナスの電気をもった小さな粒子のため、電池の+極の方へ引き寄せられます。
「電流は、電子が−極から+極へ向かう流れ」であることが分かったのです。つまり、電気の流れとは電子の流れのことだったのです。
しかし、現在でもそのまま「電流の向きは+極から−極」を使っているのは、すでに「電流の向きは+極から−極」という考え方が広まっていたため、そのまま変更されていません。
電池の役割
電気の歴史としくみはわかりましたね。
では、電気はどうやって発生させているのでしょうか?
コンセントに流れてくる電気は、火力発電所や水力発電所をはじめ、原子力や風力、地熱などさまざまな発電所で、発電機を回してつくられています。
また、近年は太陽光発電が建物の屋根などにも設置されて盛んに行われています。みなさんも目にしたことがあると思います。
太陽光発電は、太陽光が発電パネルにあたることで、電気を発生させています。
スマホやノートパソコンのように持ち運びできる機器では、電池から電気を得ています。
電池とは、化学エネルギーを電気エネルギーに変えて電気を取り出す装置です。
電池のしくみ
電池のしくみを見ていきましょう。
電池は、先ほど出てきたボルタが発明したものからはじまります。
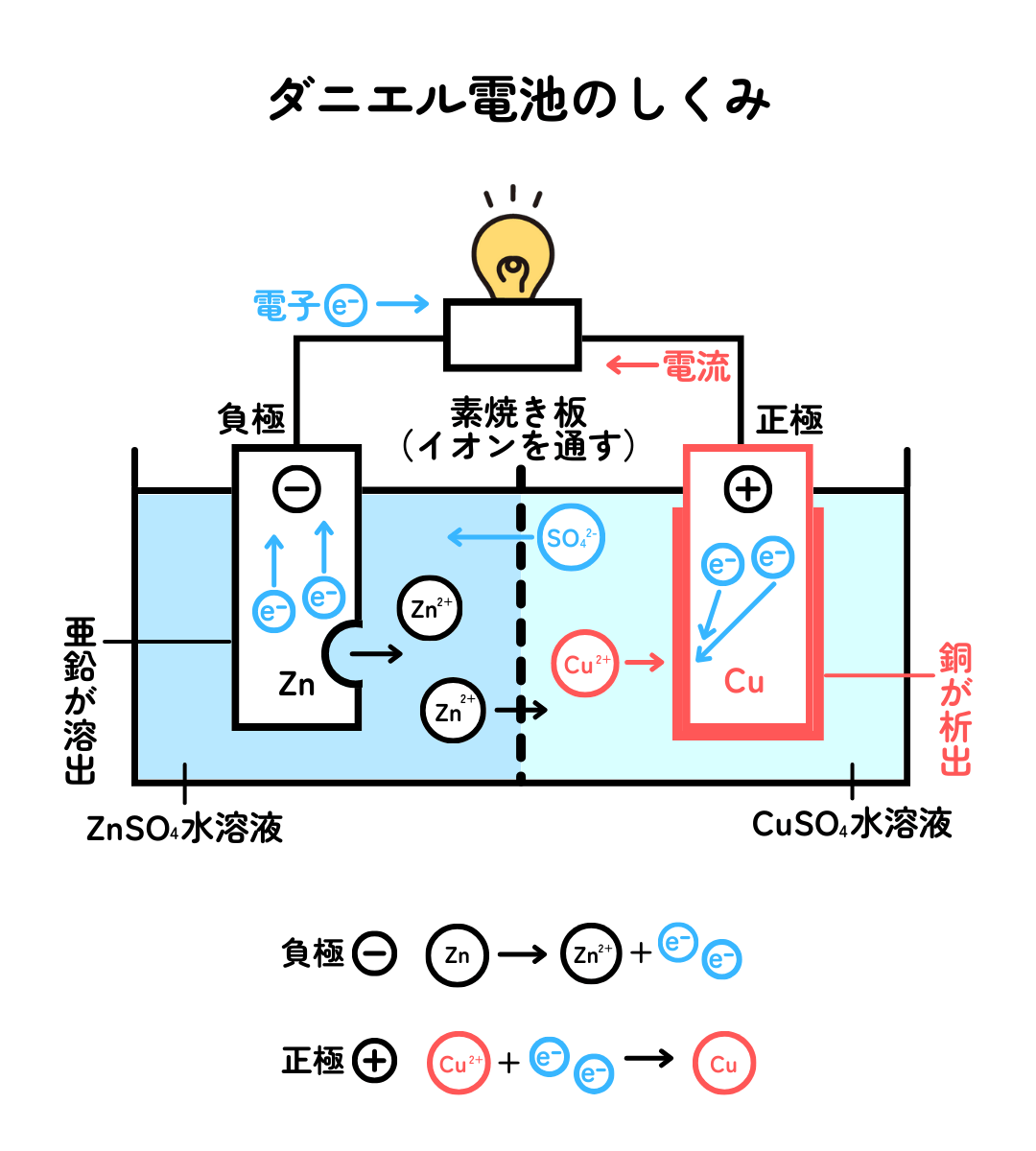
ここでは、ボルタの電池の改良版であるダニエル電池を例に、電池のしくみを説明します。ダニエル電池は、電解質水溶液に浸した亜鉛板(Zn)と銅板(Cu)導線で結んだ電池です。
-極である亜鉛板から亜鉛イオン(Zn2+)が水溶液に溶け出るとともに、電子(e-)が生じます。
その電子は、導線を通って+極へ流れていきます。
+極である銅板では、やってきた電子がプラスの電気をもつ銅(Ⅱ)イオン(Cu2+)とくっついてプラスマイナスがゼロの銅(Cu)になり、銅板上に生じます。
次の図を見て、ダニエル電池のしくみを考えてみてください。
なぜ電子が亜鉛板から銅板へ流れるかというと、亜鉛が銅よりも水溶液中で電子を出しやすいという性質があるためです。このように、金属が水溶液中で陽イオンになろうとする性質をイオン化傾向といいます。亜鉛と銅のイオン化傾向は、銅よりも亜鉛の方が大きいため、亜鉛が溶けて電子を放出し、銅(Ⅱ)イオンに向かって電子を与えやすいので、電子が流れます。
燃料電池のしくみ
次に、私たちの身の周りにある電池について考えてみましょう。
水(H2O)を電気分解すると水素(H2)と酸素(O2)が発生します。逆に水素と酸素から電気を取り出せないかと考えたのがイギリスのグローブです。
1839年に水素と酸素を溜めた試験管を電極でつなぐと、ごくわずかでしたが電気が発生することが分かりました。これが燃料電池の最初です。ただ、当時の技術では効率良く電気を得られなかったので、普及はしませんでした。
本格的に実用化に動き出したのは、1959年にイギリスのベーコンが、水素と酸素から効率良く電気を取り出すことに成功してからです。
私たちが日常で使う電池は、電池切れが起こると電池交換か充電が必要ですね。しかし燃料電池は、燃料である水素とそれを反応させるための酸素を電池に供給し続ける限り、ずっと電気を発生させることができます。
燃料電池は、月への有人宇宙飛行計画(アポロ計画)の月着陸船の電池としても採用されました。月着陸船内のコンピューターやエアコンなどを動かすための電気を燃料電池で作ったのです。なんと、できた水は飲み水となりました。
その後、一般向けが登場します。燃料電池のメリットとして、「発電効率がよい」「原料が水素と酸素なので安定して手に入れられる」「CO2を排出せず環境にやさしい」が挙げられます。そのため、燃料電池車や船舶、工場の発電のほか自宅用発電装置などに利用されています。将来は、パソコンや携帯電話の電源としても考えられています。
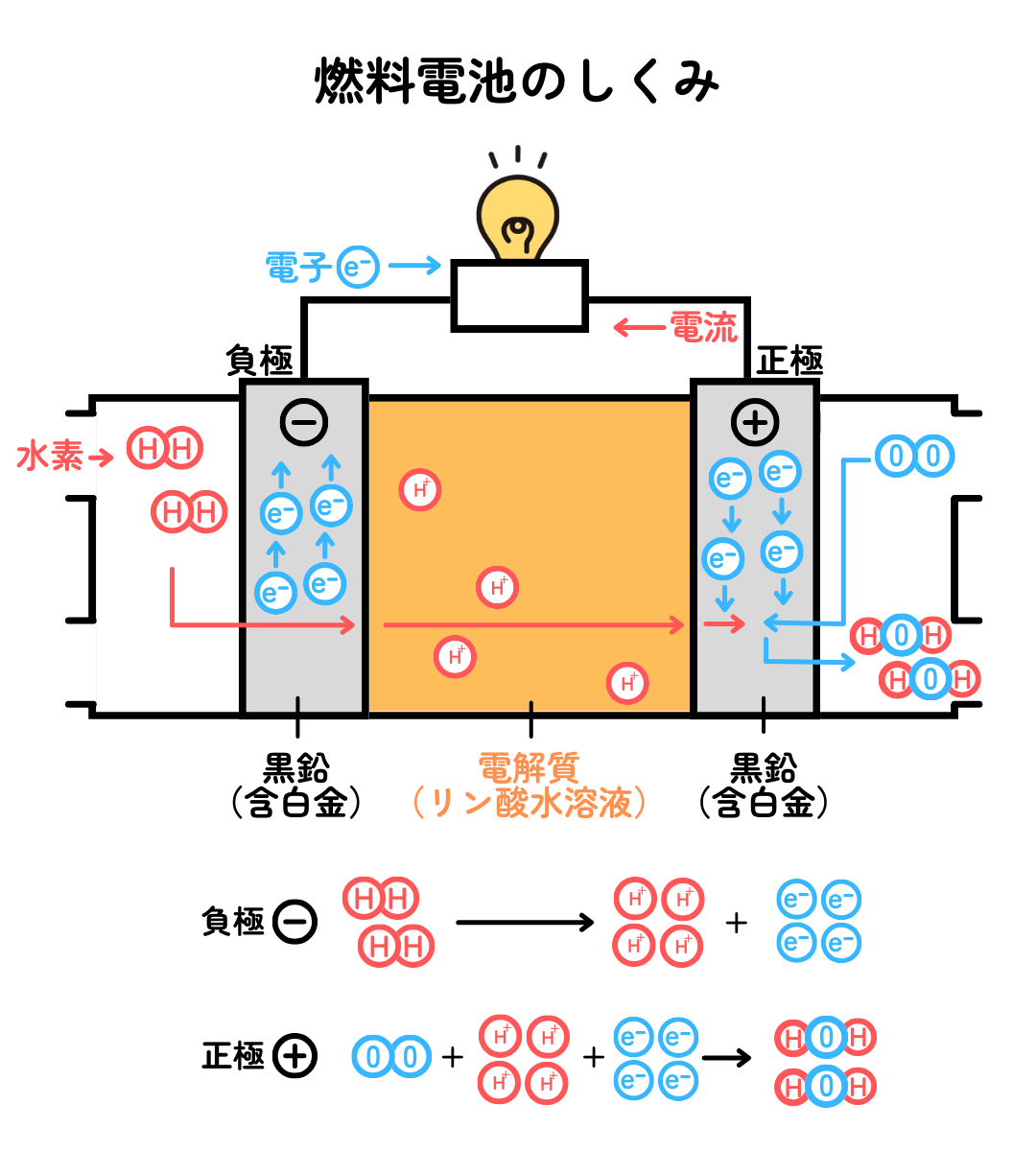
燃料電池のしくみを見ていきましょう。
水素(H2)が白金(Pt)を含む炭素電極と接触すると、プラスの電気を持つ水素イオン(H+)とマイナスの電気をもつ電子(e-)に分かれる反応が起こります。
酸素(O2)が白金を含む炭素電極と接触すると、電子と水素イオンと共に反応して、水(H2O)になる反応が起こります。
これらの反応全体は、水素と酸素が直接反応して、炎をあげて水が生じる反応式 2H2+O2 →2H2O と同じです。でも、それでは電子が取り出せないので、離れた位置で別々に反応を起こすことで、電気回路に電子を流して電気を取り出すことができます。ここで重要なのは、反応を速く進めるために必要な白金(Pt)です。この白金のような物質を触媒と言います。触媒の白金が発見されたことで、燃料電池の実用化が進みました。ただ、白金は高価な金属なので、普及の足かせになっています。白金に変わって安価で効率的な触媒が発見されれば、燃料電池はさらに普及するでしょう。
メリットの多い燃料電池ですが、課題もあります。それは、水素が保存の難しい物質だという点です。現在は特殊な金属に吸着させて貯蔵する方法などが採用されていますが、広く世の中に普及させるにはもっと取り扱いやすい物質、例えば室温で液体の状態で保存できるものが望ましいとされています。そこで、水素の代わりに考えられているのがエタノール(C2H5OH)型燃料電池です。エタノールはお酒の主成分で、室温で液体なので保存もしやすく、今後の燃料電池の燃料として注目されています。
リチウムイオン電池のしくみ
スマホやノートパソコンを動かす電池などに幅広く使われているのが、リチウムイオン電池です。リチウムイオン電池は、充放電可能な蓄電池です。電気製品を動かしたいときに「放電」させて電気を取り出し、「放電」とは逆向きの電気を流して元の状態に戻すために「充電」を行うことで繰り返し使うことができます。
この電池は、これまでの電池とは異なったしくみで電子を発生するため、性能が大きく向上しました。高性能なリチウムイオン電池が発明されたことで、世の中は劇的に変化しました。しかも、この電池の発明には日本人が関わっています。2019年にノーベル化学賞を受賞した吉野彰先生です。
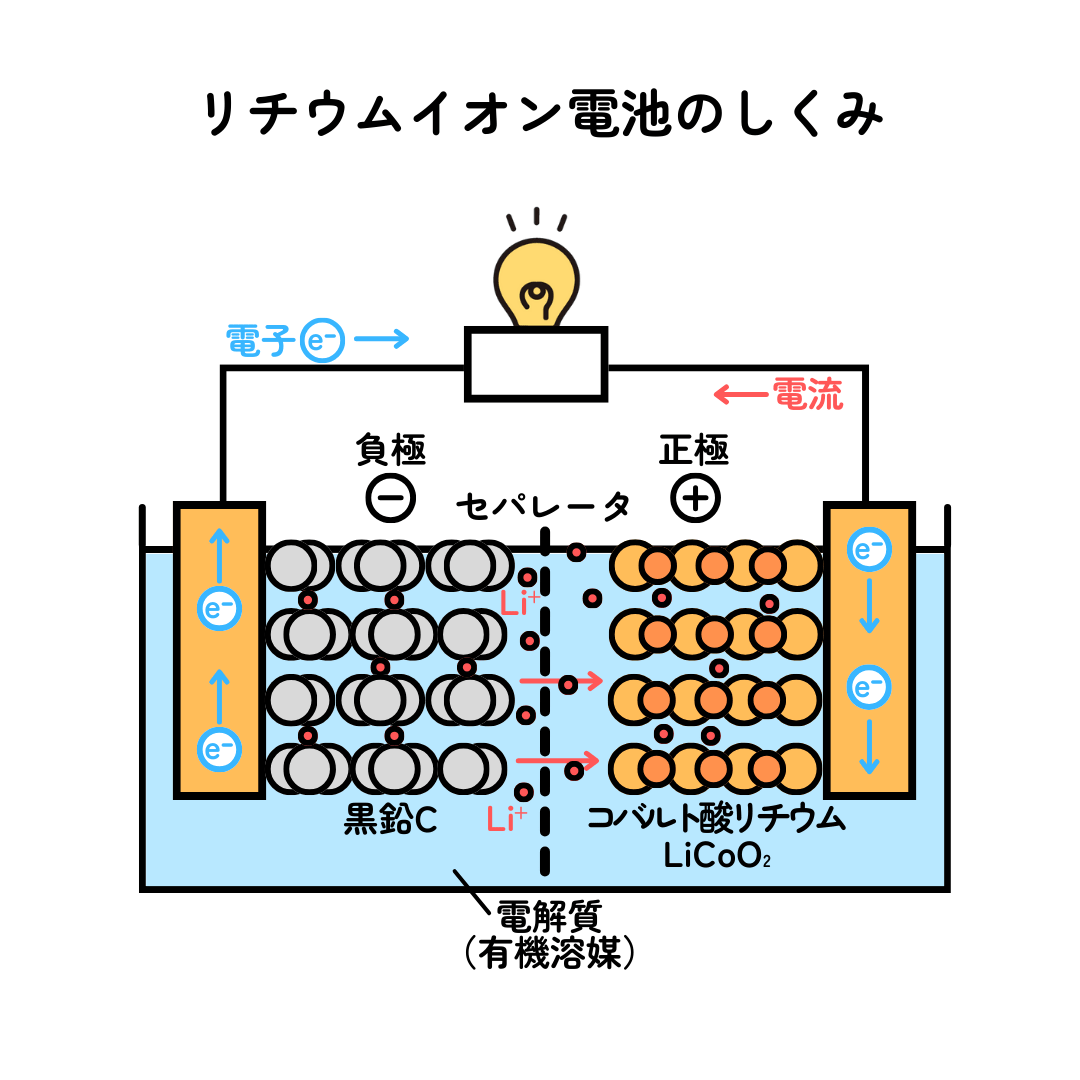
リチウムイオン電池のしくみを見ていきましょう。
リチウムイオンと電子が、電極のあいだを行ったり来たりして、放電と充電を繰り返しています。電極に用いられる材料は、負極には炭素からなる黒鉛を用いたものが使われ、正極には金属のコバルトの化合物が使われています。
リチウムイオンが使われている理由には3つのメリットがあげられます。
①リチウムは金属の中で最も軽いので、小型で軽量化ができる。
②リチウムのイオン化傾向が大きいので、電圧(起電力)が高くなる。
③電子を流すしくみが劣化を起こしにくいので、長寿命になる。
このリチウムイオン電池が発明された時期と、携帯電話が普及し始めた時期が重なったため、リチウムイオン電池の需要が飛躍的に高まり、電池の進化が加速しました。
これからの自動車
リチウムイオン電池を使って動いている自動車が電気自動車(EV)です。燃料電池車(FCV)とは電気を発生させるしくみが異なる自動車です。電気自動車(EV)は近年の普及が著しく、自動車メーカーもガソリンなどの化石燃料を使ったエンジン型の自動車をやめて、電気自動車に生産の重きを置こうとしています。
電気自動車の主な課題として、充電時間の問題があります。
ガソリン車や燃料電池車(FCV)は、短時間で燃料を入れることができますが、電気自動車(EV)で同じ距離を走れるようにするには、長時間、充電しなくてはいけません。また、原料のリチウムの価格が高いという課題もあります。
そのような課題を解決しようと、新しい物質を用いた電池の開発も進んでいます。
まとめ
ダニエル電池と燃料電池、リチウムイオン電池について、その歴史から電気が発生するしくみまで簡単に説明してきました。普段は何気なく使っている電池ですが、それぞれ実際に使われるまでの物語があり、動くしくみがあります。電池を使うときに、少しでも気になってくれたら嬉しいです。電池については、高校の化学基礎と化学でより深く学ぶことができるのでお楽しみに!
〈専門用語〉
電子:electron、e-と表す。素粒子の一つで負電荷を持つ。
イオン化傾向:金属の原子が水溶液中で電子を放出して陽イオンになろうとする性質。
触媒:反応前後でそれ自身は変化しないが、反応速度を変える働きをする物質。
記事執筆:西村能一(明治大学理工学部応用化学科卒 / 7年間の私立高校教諭勤務を経て、現在は予備校講師)
記事監修:秋津貴城(東京理科大学 理学部第二部 化学科 教授)
関連記事Recommend
-

【科学の秋】紅葉はなぜ起きる?植物の色が変わるワケ【動画解説】
-

【日本の偉人】日本人初のノーベル賞受賞に至るまでの軌跡【湯川秀樹/動画解説】
-

【中学生向け】原子の構造と化学式の書き方
-

硫酸実験4選 砂糖が膨らんで真っ黒!?段ボールがボロボロに!?【動画で解説、話題の実験】
-

【博物館訪問動画】芸術と科学が融合するインターメディアテク(東京駅直結)に潜入!
-

【中学生向け】PETボトルは何からできているの?
-

【実験動画】一瞬で凍る魔法の液体!?「ホットアイス」
-

【ピタゴラスの雑学】“三平方の定理”は意外なところで生まれていた!現代にも活用?【動画で解説!偉人の証明】
-

【化学の基礎】元素周期表の意外な歴史を動画で解説!
-

親子で楽しもう、身の回りのサイエンス
第11話「湿度を測ろう」中学生向け