高校・大学受験や理系の仕事解説など、中学生・高校生の進路選びに役立つ情報をお届け。

【中学生向け】原子の構造と化学式の書き方
皆さんは、化学というとHやOといった元素記号を思い浮かべるのではないでしょうか。では、HとOは何が違うのでしょう?これが良く分からないから、化学が難しいと思われているのかなと思います。HとOの違いを知ることで、化学を楽しむための一歩を踏み出しましょう!
原子の構造<原子の中を見てみよう>
①元素
私たちのまわりにあるものはすべて物質で、化学はその物質の構造や性質について学んだり、物質どうしを反応させて新たな物質を作りだしたりする学問です。
物質を構成する基本的な成分を元素(げんそ)と言います。118種類が知られていますが、天然には約90種類存在し、残りは人工的に作られます。
それら元素は、水素はH、酸素はO、鉄はFeのように、元素記号を使って表されます。元素は組み立てブロック の一つ一つのパーツみたいなものです。組み立てブロックのいくつかのパーツを組み合わせて、恐竜や車、お城など、様々なものを作りますよね。 物質も、元素を組み合わせて、色々なものを作っています。
②原子の構造
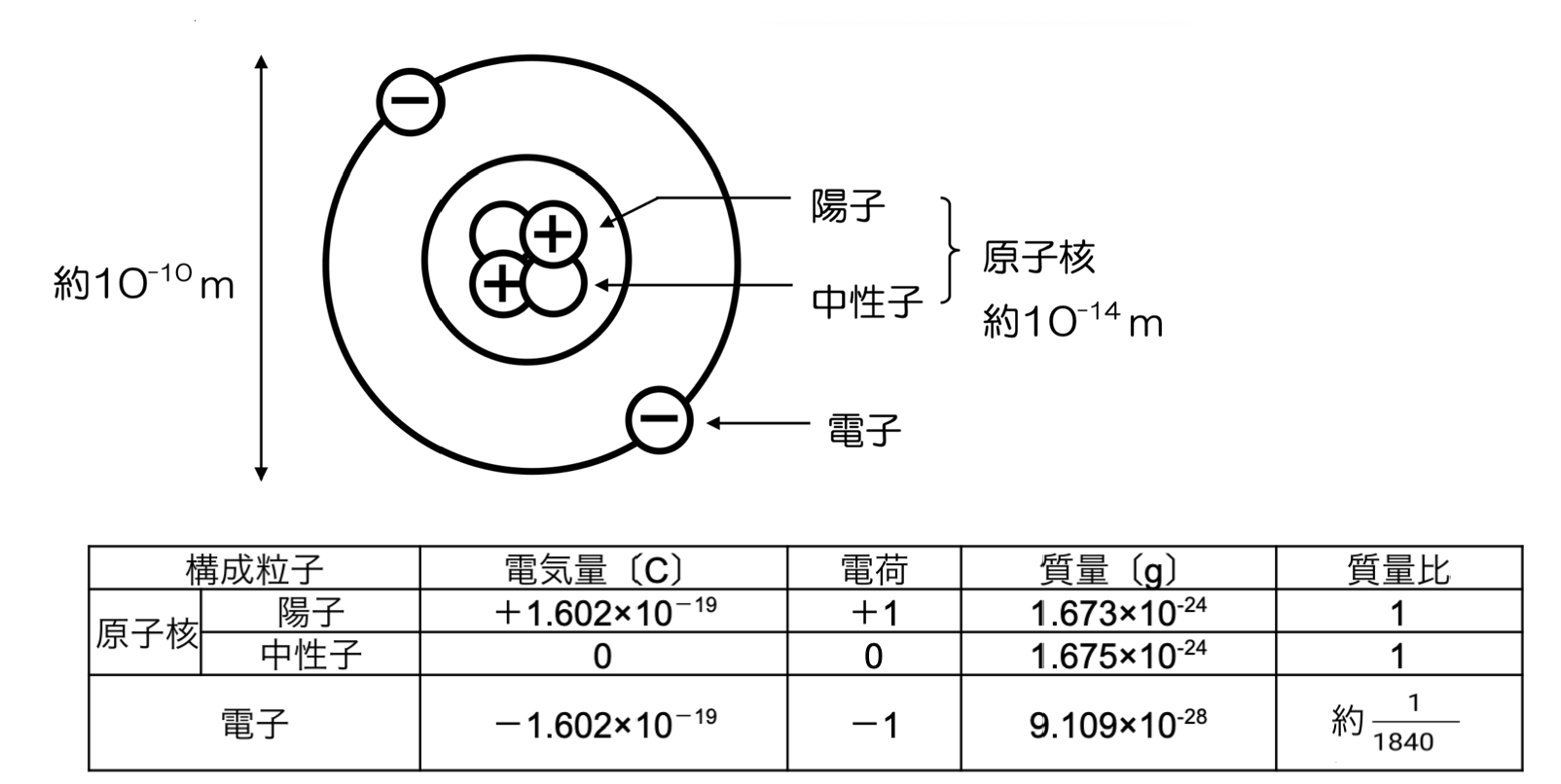
物質を構成する最小の粒子を原子と言います。原子は、中心にある原子核と、原子核のまわりに存在する負の電荷をもった電子からなります。さらに、原子核を構成する正の電荷をもった粒子を陽子、原子核を構成する電荷をもたない粒子を中性子と言います。
原子の直径は約 1 1010 (10-10 )mですが、原子核の直径はさらに小さく、原子の約1万分の1の約 1 1014 (10-14)mになります。原子の大きさを東京ドームとすると、原子核の大きさはビーズ玉くらいの大きさと言えます。陽子と中性子の質量はほとんど同じですが、電子の質量は、陽子や中性子の質量の約 1 1840 になります。
陽子は正(プラス)の電気を帯びており、電子は反対符号の負(マイナス)の電気を帯びています。陽子1個と電子1個がもつ電気量は同じなので、同じ数の陽子と電子があると、電気的に打ち消し合います。原子の中の陽子と電子は同じ数なので、原子全体の電気は±0になっており、これを電気的中性と言います。
③原子の表し方
原子核に含まれている陽子の数を原子番号と言い、原子番号は、水素Hが1、ヘリウムHeが2、酸素Oが8と決まっています。陽子の数は元素固有のもので、陽子の数の違いが元素の違いになります。
また、原子核に含まれる陽子と中性子の数の和を質量数と言います。原子の原子番号や質量数を表すときは、元素記号の左上に質量数、左下に原子番号を書きます。
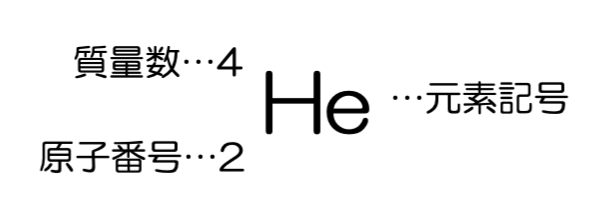
④同位体
原子番号が同じで、質量数が異なる原子同士のことを同位体と言い、化学的な性質はほぼ同じです。水素には、 1 1 H、 2 1 H(重水素)、 3 1 H(三重水素)が存在します。これらは同じ元素ですが、異なる原子です。同位体のうち、原子核から放射線を放って他の原子に変化するものを放射性同位体と言い、 3 1 Hが放射性同位体ですが、天然にはごくわずかしか存在していません。地球上の元素の多くは、何種類かの同位体がほぼ一定の割合で混ざって存在しています。

電子配置<電子はどこにある?>
①ナトリウム原子の電子配置
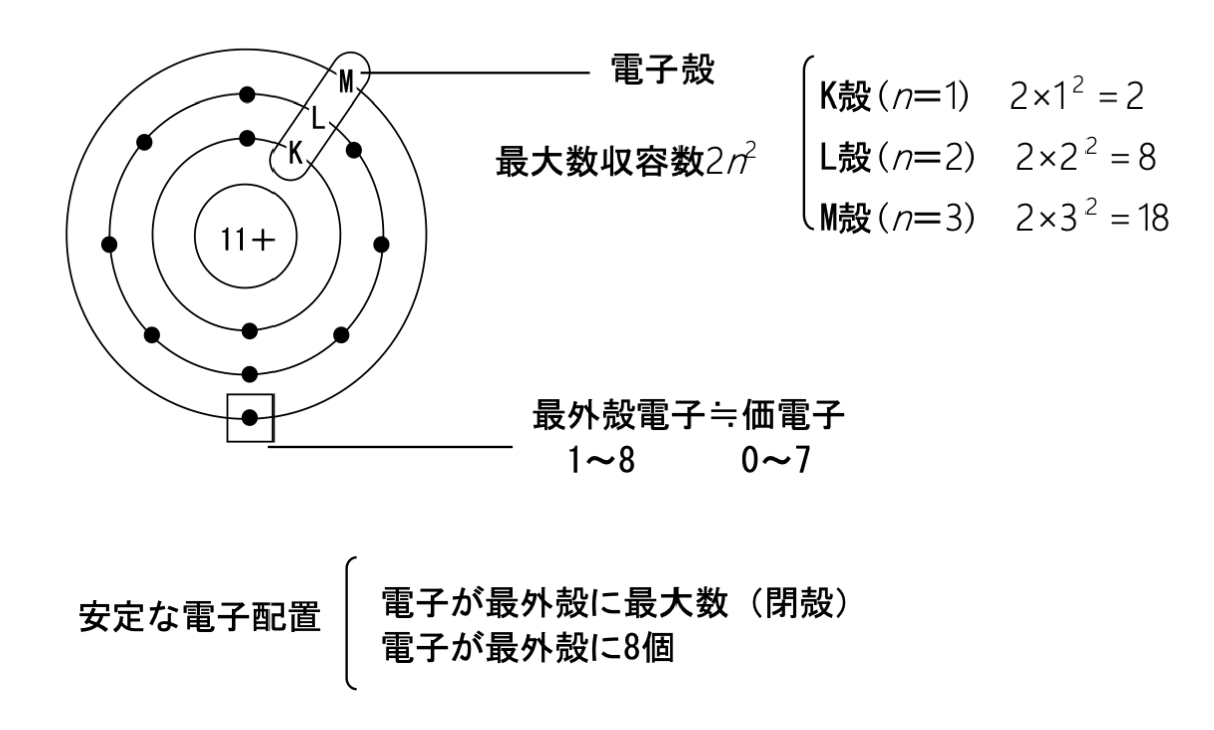
ナトリウム原子について考えてみましょう。ナトリウム原子の陽子の数は11個なので、電子の数も11個です。そして、11個の電子は同じところに入っているわけではなく、原子核のまわりにあるいくつかの層に分かれて存在しています。この層を電子殻と言います。電子殻は内側からK殻・L殻・M殻・N殻・・・とよばれ、それらの電子殻に入ることができる電子の最大数は、それぞれ2n2個(K殻n=1、L殻n=2・・・)です。
原子核のまわりの電子は、原子核に近いものほど原子核に強く引きつけられ安定した状態になるので、電子は原則として原子核に近いK殻から順番に入っていきます。ナトリウム原子では、K殻に2個、L殻に8個、M殻に1個の電子が入ります。このような電子殻への電子の配列のしかたを電子配置と言います。
原子の一番外側にある電子を最外殻電子と言います。原子を原子番号の順に並べて電子配置を比較すると、最外殻電子の数は周期的に変化していることがわかります。
この最外殻電子は、原子がイオンになったり、原子同士が結び付いたりするときに重要なはたらきを示します。このように最外殻にあり、結合やイオンの生成に関係する1~7個の電子を価電子と言います。価電子の数が同じ原子同士は、化学的性質がよく似ています。
②原子の電子配置
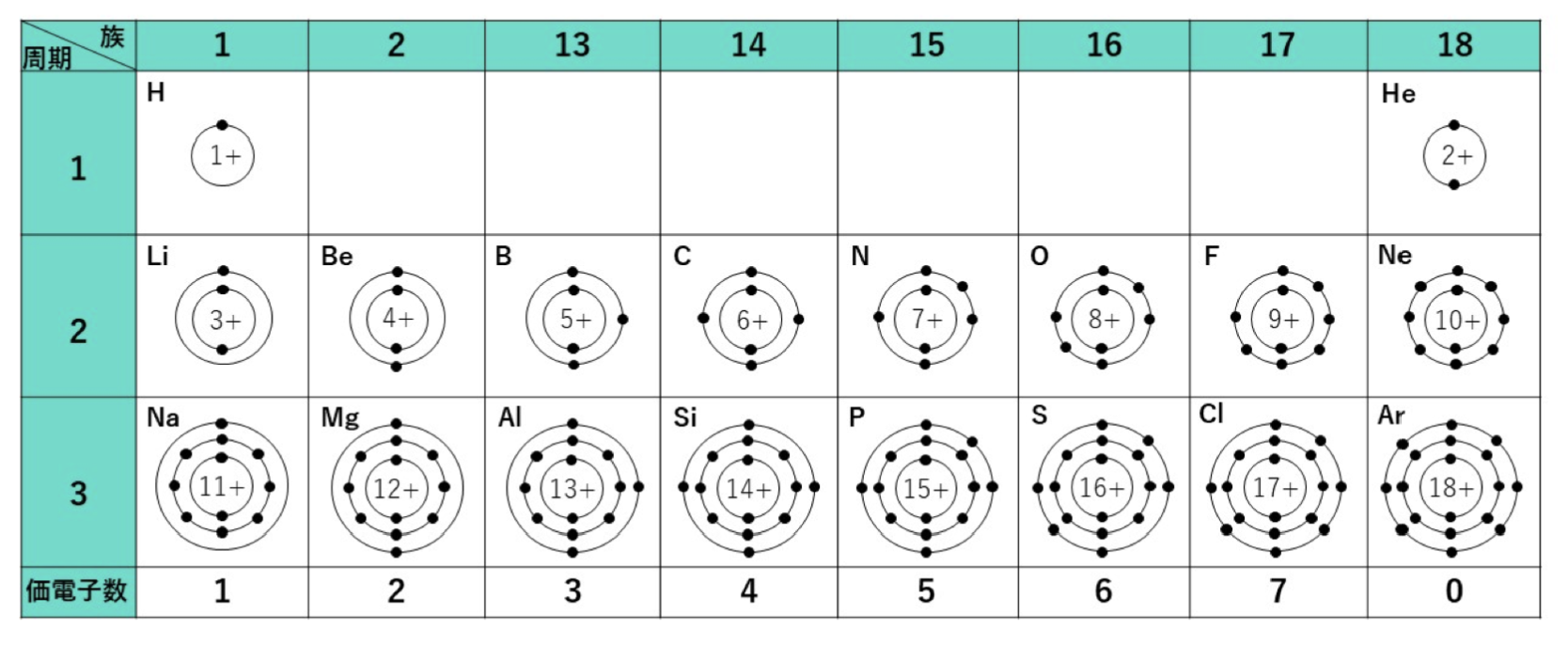
原子のヘリウムHeのK殻、ネオンNeのL殻のように、最大数の電子で満たされた電子殻を閉殻と言い、最外殻が閉殻あるいはアルゴンArのM殻のように、最外殻電子の数が8個の場合、その電子配置は安定です。
He、Ne、Arなどの元素は貴ガスとよばれ、電子配置は安定でイオンになったり他の原子と結び付いたりしにくく、反応性が乏しいため、貴ガスの最外殻電子の数は2個または8個ですが、価電子の数は0個としています。
イオン<電気を帯びたらひっぱり合う>
原子が電子の授受を行って、安定な貴ガスの電子配置をとったときに生じた、「正または負の電荷を持った粒子」をイオンと言います。イオンは元素記号の右上に価数と電荷の正負を表す符号(+、-)を付けたイオン式で表され、放出したり受け取ったりした電子の数を、イオンの価数と言います。
①陽イオンの生成
原子が電子を放出すると、正の電荷をもつ陽イオンになります。ナトリウム原子は、電子を1個放出して、1価の陽イオンであるナトリウムイオンNa+になります。
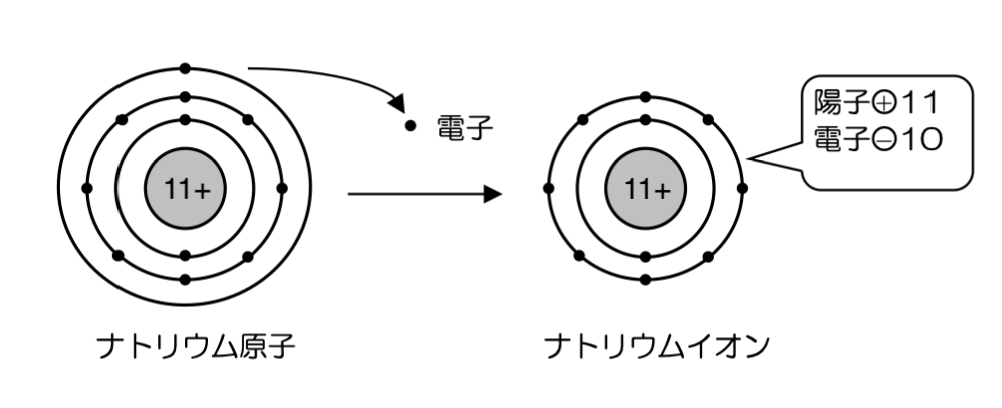
②陰イオンの生成
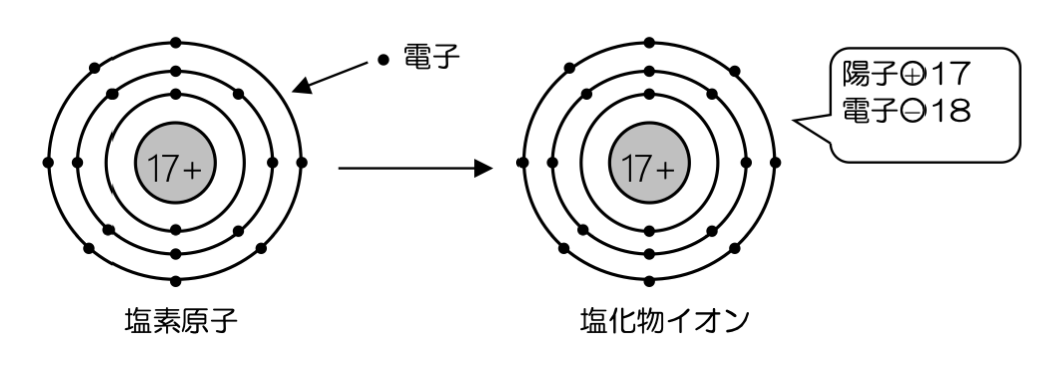
原子が電子を受け取ると、負の電荷を持つ陰イオンになります。塩素は電子を1個受け取って、1価の陰イオンである塩化物イオンCl-になります。
元素の周期表<水兵リーベ、僕の船>
①周期表の活用法
周期表は何の順番に並んでいるでしょうか? 原子番号の順、すなわち陽子の数の順です。では、元素が変わると性質が変わるのはなぜでしょう。それは、原子は陽子によるプラスと電子によるマイナスが打ち消し合うように増減するので、正の電気を帯びた陽子が1個増えれば、負の電気を帯びた電子も1個増えます。そのため、「最外殻に存在する電子のうち結合に関与する電子(価電子)の数が元素によって異なるから」です。
元素を原子番号の順に並べると、性質のよく似た元素が一定の間隔で現れます。これを元素の周期律と言います。元素に周期律があるのは、原子番号の増加に伴って、価電子の数が周期的に変化しているためです。そして、元素を原子番号の順に並べて、性質のよく似た元素が同じ縦の列に並ぶように配列した表が元素の周期表です。では、その周期表の活用法について見ていきましょう。
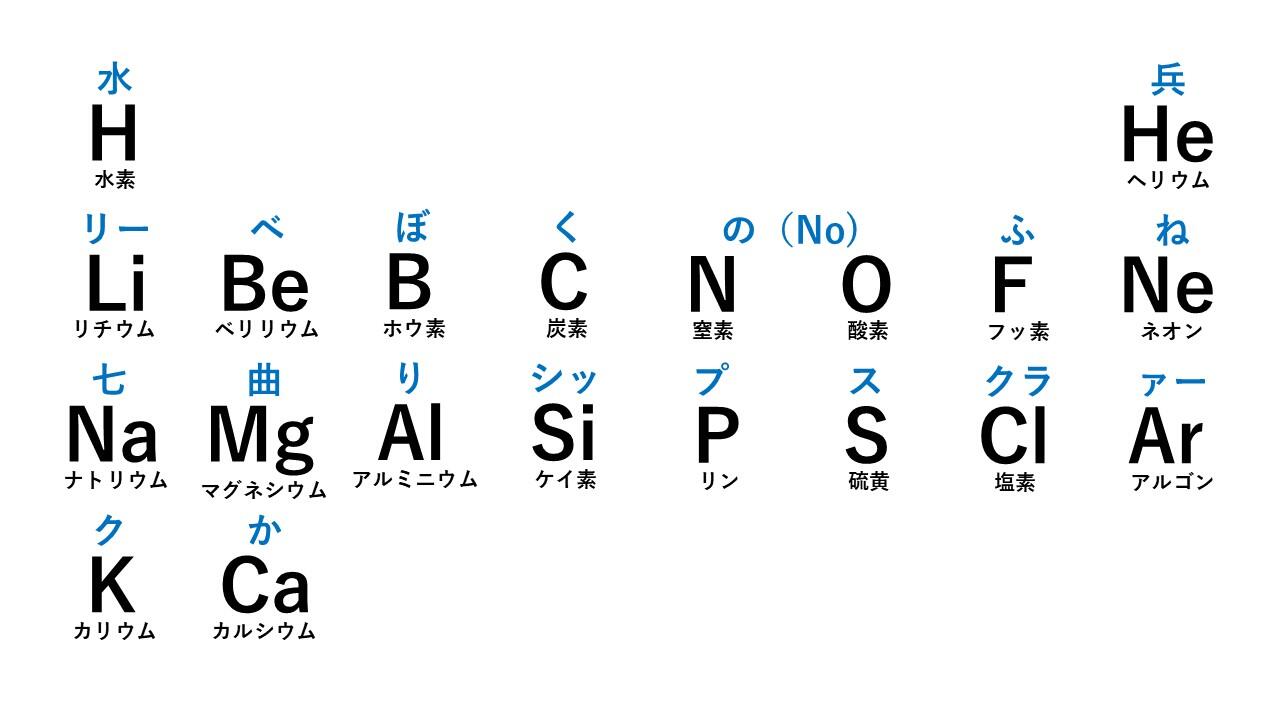
有名な語呂合わせである周期表の覚え方「水兵リーベ僕の船七曲りシップスクラークか」の順に元素記号が並んでいます。このとき、折り返す場所がポイントです。「水兵」「リーベ僕の船」「七曲りシップスクラー」「クか」で区切って並べていきます。
②化学式の書き方
化学式をつくるにあたって大切なのは、元素の周期表です。その活用法がわかると化学式は簡単に書けるようになります。化学式の書き方は次のとおりです。

筆者が化学を学びはじめたとき、イオンの価数を覚えるのが苦手でした。試験のときは、始まるとすぐに問題用紙に周期表を書き、その周期表を見て、元素が何価の何イオンになりやすいかを確認していました。筆者が化学式をスラスラと書けるようになったのは、高校で化学の先生が配ってくれたプリントのおかげです。下に示した二つの表は、そのとき使っていたプリントを参考に自分でつくりました。縦に陽イオン、横に陰イオンが書かれていて、化学式をつくる練習ができます。
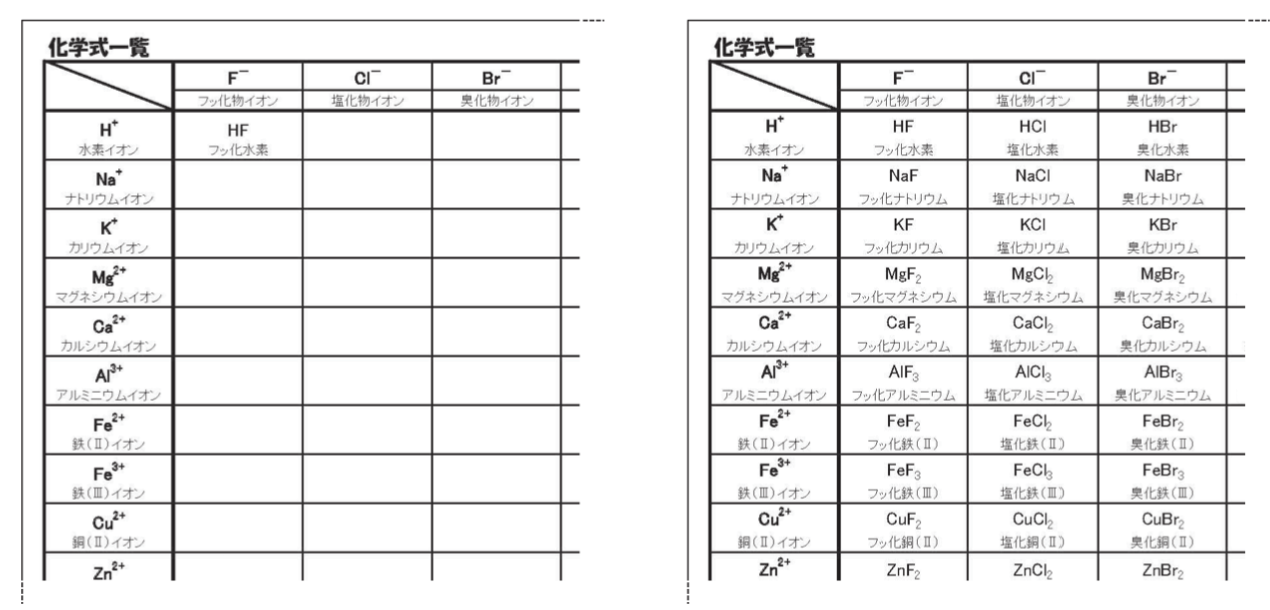
筆者がこのプリントに出合ったとき、大きな衝撃を受けました。それまで、化学式は覚えるしかないと思っていましたが、周期表でイオンの価数がわかれば考えて書けるようになることに気付いたからです。
まとめ
元素記号や化学式は単なるアルファベットの塊ですが、化学に関わる人は、それらを見て物質の性質を理解し、反応が起こる理由を当たり前のように考えています。元素記号の意味を知って、化学の世界を楽しんでいきましょう!
関連記事Recommend
-

【科学の秋】紅葉はなぜ起きる?植物の色が変わるワケ【動画解説】
-

【日本の偉人】日本人初のノーベル賞受賞に至るまでの軌跡【湯川秀樹/動画解説】
-

硫酸実験4選 砂糖が膨らんで真っ黒!?段ボールがボロボロに!?【動画で解説、話題の実験】
-

【博物館訪問動画】芸術と科学が融合するインターメディアテク(東京駅直結)に潜入!
-

【中学生向け】PETボトルは何からできているの?
-

【実験動画】一瞬で凍る魔法の液体!?「ホットアイス」
-

【ピタゴラスの雑学】“三平方の定理”は意外なところで生まれていた!現代にも活用?【動画で解説!偉人の証明】
-

【化学の基礎】元素周期表の意外な歴史を動画で解説!
-

親子で楽しもう、身の回りのサイエンス
第11話「湿度を測ろう」中学生向け
-

【中学生向け】富士山の山頂でご飯がおいしく炊けないのはなぜ?


