リケラボは研究者、研究開発・技術職など理系の知識を生かしてはたらきたい人を応援する情報サイトです。

仮に、老化を病気と捉えればどうなるだろうか。病気であれば、何らかの方法で治せるのではないか。そんなひらめきを学部生時代に得た慶應大学医学部および理工学部特任講師の早野元詞氏は、創薬による老いの治療をめざしてトランスレーショナルリサーチの道へと進みました。その後、アメリカに留学し、ベストセラー『LIFE SPAN』の著者であり老化研究の第一人者でもあるDavid A.Sinclair教授の元で研究に取り組んで帰国。研究成果を社会実装するには、多分野に渡る研究者や事業家との幅広いつながりが欠かせない。そう考える早野氏は、自らの研究を深めると同時に成果を活かすベンチャー起業に取り組み、さらに共同研究を促す仕組みづくりにも力を入れています。「世界を変える研究に取り組み、成果を社会に届けたい」と語る早野氏に、研究が秘める未来を変える力について伺いました。
難病に苦しむ人を救う、そのため自分に何ができるか
そもそも研究者をめざしたキッカケは何だったのでしょうか。
早野:大学3年のときにウェルナー症候群を知ったことです。ウェルナー症候群とは遺伝性疾患の一つで、思春期を過ぎたぐらいから早くもさまざまな老化現象に悩まされる「早老症候群」です。人は歳を取れば誰もが老いていく、けれども世の中には“若いにもかかわらず老いる”病に苦しむ人がいる。老化とは一体何なのかと関心を持つようになり、もしも老化が病なのであれば薬で治せるのではないか、老化の薬はどうやったらつくれるのかとイメージを膨らませていったのです。
老化のメカニズムはここ数年で、かなり解明されてきたようですね。
早野:いまラボでは、ICEマウスを使った研究を行っています。ICEマウスとは、遺伝子の特定箇所のDNAにダメージを与えて、人工的に老化のスイッチを入れたマウスです。2013年から米・ハーバード大学のDavid教授のもとで、このICEマウスの構築に携わりました。ICEマウスをつくりだせたおかげで、白内障や骨粗鬆症を発症させたり筋肉や視力を低下させるなど、老化に伴う現象を明らかにしてきました。このようなDNA損傷により老化が引き起こされる現象は、in vitro(=シャーレ上での培養細胞レベル)では以前から知られていましたが、in vivoつまり生体内で確認されたのは、このときが世界でも初めてでした。
※早野氏が筆頭著者となっている論文は下記サイトに掲載されている
https://www.biorxiv.org/content/10.1101/808659v1
DNAが損傷すると、老化が始まるのですか。
早野:約2万1000個あるとされる人間の遺伝子は、適材適所といった感じで肝臓、心臓などそれぞれの臓器で機能しています。しかし、DNA損傷が起こると細胞はそれを「エピゲノム」という形で記憶し、老化を加速させるのです。例えるなら、たくさんある遺伝子が通常は物置の中でキチンと整理されています。ところが地震が起こると、中がめちゃくちゃになってしまい、適切な遺伝子を取り出して使えなくなる。こんな感じで老化のスイッチが入るのです。
原因がわかっているなら、老化を抑えられそうです。
早野:とはいえ大学を卒業した15年ほど前の段階では、老化の研究は今のレベルとは程遠いものでした。それでも老化を抑える薬づくりに関わりたいと考えて、大学院は東京大学のメディカル新領域研究科に進みトランスレーショナルリサーチに取り組みました。やがて研究を深めるにつれて、研究者と医者だけでは老化の薬をつくれないのではないかと疑問がふくらんできたのです。もどかしい思いを抱えているときに、David教授を知りました。David教授は老化に関して世界最先端の研究に取り組みながら、自らベンチャーを起業して研究成果を社会に還元している。自分の進路の選択肢として起業があることを知り、この人こそは自分のロールモデルだと考えたのです。
無視された6通のメール
そこでアメリカに留学したのですか。
早野:それが、そんな簡単な話ではありませんでした。当時のDavid教授はHarvard Medical School(HMS)でAgingの研究を行いながら、製薬ベンチャーを興して大成功し、他にも数社のco-Founderを務めるなど多忙を極めていたのです。研究員として採用してほしいとメールを送ったものの、何の音沙汰もありません。その頃は東京都医学総合研究所(当時は東京都臨床医学総合研究所)で東京大学の正井久雄博士の研究室に所属し、論文でもある程度の成果を出していたのですが、半年ぐらい無視され続けました。それでも諦めずにしつこくメールを送り続けた結果、2013年にようやく採用となったのです。
ハーバードでの一番の学びは何だったのでしょう。
早野:David教授の口癖は「Change the world」です。研究とは社会に還元し世界を変えるべきものだと説く教授からは、研究者が持つべき強い使命感を間近でひしひしと感じました。当時、アメリカからヒューマン・フロンティア・サイエンス・プログラム(HFSP)に応募するため、申請書をDavid教授に見てもらったときにいわれたひと言、“Does your proposal change the world?”、この言葉も未だに忘れられません。とはいえ世界を変えるアイデアを、個人で実現するのは不可能です。自分にはない知を持つ人々とのネットワークをつくらなければならない。その意味でもDavid教授は徹底していました。あらゆる研究テーマが常に、幅広い研究者との共同作業を前提としているのです。何しろ研究室には実験に必要な水をつくる機械さえなく、水が必要なら別の研究室からもらってこなければならない。これも他の研究室との共同作業に徹する姿勢の表れなのです。ちょうど当時のボストンではバイオテックスタートアップがたくさん出始めていました。研究者たちがスタートアップを起こすプロセスを目の当たりにし、そのエッセンスを学べたのは幸運だったと思います。
巨人の肩の上に立ち、見えた新世界
エイジング研究での最新の成果を教えてください。
早野:老化を誘導したマウスを調べていてわかってきたのが、加齢により細胞がアイデンティティを失う現象です。人の体は約37兆個の細胞でできているとされますが、一人の人に関しては全ての細胞のDNA配列は同じです。1個の受精卵からさまざまな細胞に分化していき、最終的に臓器や筋肉、血管、皮膚、神経などの細胞となる。DNA配列は同じながらも、臓器の細胞なら、細胞分裂するときちんと臓器の細胞となります。筋肉などほかの細胞も同様で、各細胞が独自のアイデンティティ持っているわけです。ところが加齢により、このアイデンティティが失われてしまい、例えば筋肉細胞が免疫細胞のようなアイデンティティに変わってしまう。そうなると、当然さまざまな不都合が起きてきます。こうした不都合を改善する研究成果を、つい最近David教授が出しました。老化が進んだ視神経に、細胞を初期化する山中ファクターを入れると若返り、元の視神経のアイデンティティを取り戻したのです。これは老化した視神経の細胞に、自分が視神経であることを思い出させたといえます。この成果を受けて我々は、さらにその先を見ています。
まさにニュートンが語った「巨人の肩の上に立つ」わけですね。
早野:David教授が見つけてくれた知見を足がかりに、次の世界に進もうと挑戦しています。具体的には、老化した視神経の細胞の中に入れた山中ファクターが、どのように作用したのか。そのメカニズムを突き止めるため、ラボのICEマウスに遺伝子改変技術のCrisper Cas9や、分子化合物を使って若返りの研究しています。精密な遺伝子編集を行いながら、遺伝子の活性化や不活化によるエイジングの原因を探っているところです。これと並行して、加齢により筋力低下を起こすサルコペニア改善に効果をもたらす薬剤の開発にも取り組んでいて、治験を計画しています。
光を使った研究にも取り組んでいると聞きました。
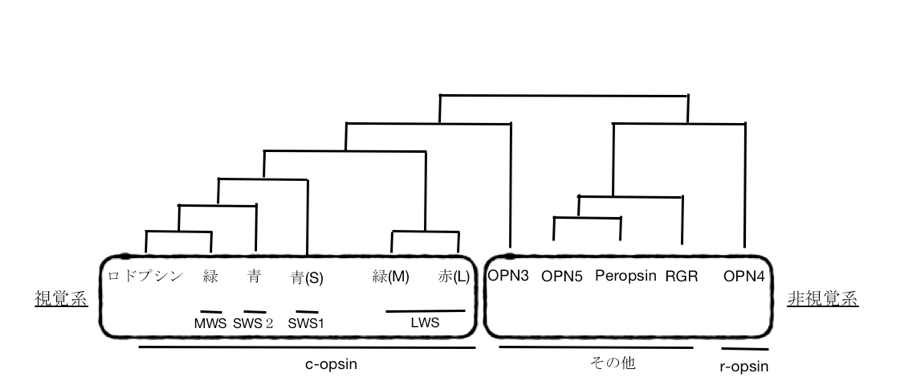
早野:光も実に興味深い研究テーマです。光とは見るものであると同時に、あまり知られていませんが感じるものでもあるのです。動物に眼ができたのは6億年前です。つまり生命が誕生してから約31億年ものあいだ、生物にとって光は、視覚とは係のない用途で使われていました。その用途とはシグナルです。光を感じ取ることで、生物は何らかの反応を起こす。いま注目しているのがバイオレットライト、紫の光です。人間の眼には9種類の光受容体がありますが、そのうち視覚系の光受容体が4つで、残り5つは非視覚系なのです。
非視覚系の受容体は、紫の光をシグナルとして感じているのですか。
早野:OPN5と呼ばれる非視覚系の受容体があります。これが360から400ナノメーター、つまり紫の光に特異的に反応する受容体です。紫は高貴な色、あるいは怪しい色と表現されたりもしますが、実はこの紫色の光が、OPN5を活性化し近視を抑制することがわかっています。アジア諸国の20歳時点での近視率をみると、1950年代には20%程度だったのに対して、2010年には軒並み80%ぐらいまで高まっています。なぜ、こんなことが起こっているのか。考えられる仮説の一つが、紫の光を浴びていないことです。紫の光は太陽光に含まれていて以前の子どもたちは1日に3~4時間屋外で遊び、紫の光をたっぷり浴びていました。これが室内で遊ぶようになった結果、紫の光を浴びなくなった。室内の人工光には紫の光が含まれていないために、何らかのシグナルが働かなくなり近視が増えた可能性があります。
太陽光には紫の光は含まれているけれども、人工的な室内光には紫はないわけですね。
早野:昔から日照時間や屋外活動と認知機能やうつ病の関係は知られていました。そこで次に我々は体に負担が少ない方法で老化を制御する方法として紫の光に着目しました。ラボで高齢マウスに対して、選択的に紫の光を当てる実験を行った結果、短期記憶と長期記憶がともに格段に高まり、睡眠に対する改善効果も見られました。ブルーライトは眩しくて日常生活に使いにくいし、紫外線は人体に危険です。ところが、その間にある紫の光はこれまでの研究成果では安全性も高く、非常にたくさんの良い効果を及ぼしてくれる。紫の光は日常生活の中でも眩しくないので普段の生活の中でもっと意識的に浴びるようにすれば、さまざまな改善効果を期待できます。
事業化により未来を変える
サルコペニアの治療薬同様に、紫の光についても実用化を考えているのですか。
早野:紫の光の活用については、恩師の坪田先生が運営されている株式会社坪田ラボでChief Science Officerとして研究に取り組んでいます。紫を発光する仕組みを取り込んだ、アプリやゲームなども面白いと思います。このゲームなら画面を見ているだけで健康になるので「いい加減にゲームをやめなさい」ではなく「もっとゲームしなさい」と子どもを注意するような状況が生まれるかもしれません。
2021年4月からは、慶應義塾大学の理工学部システム工学科にも所属していますね。
早野:量子コンピュータを活用したAIやシミュレーションを、老化の予測や治療に取り入れていきたいのです。慶應や連携大学の医学部には高齢者の臨床リアルデータがあります。このビッグデータに加えて、これまで培った老化のメカニズムや薬のメカニズムをAIで解析、シミュレーションすれば、エイジングをより多角的に理解できると期待しています。
そして自らもバイオテックベンチャーをつくろうとしている?
早野:サルコペニアを改善する化合物を見つけたので、これを薬として提供したいのです。サプリメントではなく、いつ・どれだけ・どのように服用すれば効果があるのかが明確な薬として提供する。既に明確なエビデンスを持っているので、きちんと治験を通して提供したいと考えています。ただし、老化を治療するには開発ターゲット、承認プロセス、患者選定が非常に難しく、予防をターゲットとした場合は希少疾患やデジタルセラピューティクスのように新しいビジネスモデルの確立が必要です。ベンチャーを起業して成長軌道に乗せていくのも、これからの重点課題です。
研究者コミュニティのパワーを活かす
自らの研究を進めるだけでなくエコシステムを根付かせるための活動にも力を入れていますね。
早野:研究成果を社会実装するためには、エコシステムが必要であり、エコシステムを構築するためには、一人ではいくら頑張ってもダメなのです。そこで一般社団法人ASG-Keioを立ち上げて、2020年4月から分野を超えた若手研究者の勉強会『Scienc-ome』を開催しています。コロナ禍によりリアルな学会が当分なくなるだろうから、オンラインでの勉強会を考えました。毎週水曜日に1時間、最先端の研究をプレゼンテーションする。この勉強会にはモチベーションの高い研究者が集まるだけでなく、事業会社の人も次の種を探しに来ているし、未来の研究者候補となる高校生も参加しています。
専門とは異なる分野の研究に刺激を受けるケースもありそうです。
早野:エッジの効いた研究は、アンテナを高く張っている人には必ず何かのヒントをもたらしてくれます。Scienc-omeの特徴は、オンライン開催で場所を問わないメリットを活用し、世界中に散らばっている日本人研究者が参加していることです。海外の大学でPI(=Principal investigator:研究室の主宰者)となっている研究者、それでいて若手となれば、実力派が揃っています。そんな人たちが、最新の研究成果を発表するのだから、中には事業会社の目に留まる発表もあり、Scienc-omeをキッカケとした新たな展開も生まれているようです。
ヒューマン・フロンティア・サイエンス・プログラム(HFSP)に2014年に参加していますが、このプログラムで何を得られましたか。
早野:HFSPは、日本の若い研究者が積極的に応募するといいなと思います。これはライフサイエンス分野における革新的な国際共同研究を推進するため、1989年に創設された国際プロジェクトです。参加希望者に求められるのは、“海外での新たな研究分野への挑戦”、つまりこれまでの自分の殻から外へ出なければなりません。もちろん応募したからといって簡単に採択されるわけではありませんが、採択されれば助成金などのメリットはとても手厚い。その結果、過去30年間に世界中で28人ものノーベル賞受賞者を輩出してもいます。ところが挑戦する日本人がほとんどいない現状には、もどかしさを強く感じます。
これから研究の世界に飛び込もうと考えている人、また既に研究者として歩み始めている人へのメッセージを聞かせてください。
早野:まず自分なりの「問い」を持つことが何より大切です。そのうえで安易に答えを求めるのではなく、まずロールモデルを見つけて自分の殻を一度打ち破ってください。そうすれば新しい知のネットワークが広がっていくはずです。今やオンラインで世界中の研究者とつながっていける時代です。視野を広く持ち、“創薬や画期的な治療法の開発により、この世界を変えてやるんだ”と、そんな意気込みを持つ研究者が後に続くことを期待します。
早野元詞(はやの もとし)
熊本県生まれ。2005年熊本大学理学部卒業、2011年に東京大学大学院新領域創成科学研究科にて博士号(生命科学)を取得。2010年より東京都医学総合研究所所員、日本学術振興会海外特別研究員、Human Frontier Science Program Fellow、ハーバード大学医学部客員研究員などを経て、2017年から慶應義塾大学医学部眼科学教室特任講師、株式会社坪田ラボでChief Science Officerを務め、2021年より慶應義塾大学医学部精神・神経科学教室(三村將教授)および慶應義塾大学理工学部システムデザイン工学科(満倉靖恵教授)の特任講師。医学部では眼科学教室の伴紀充講師と共同ラボ(網膜老化生物学チーム)を運用している。一般社団法人ASG-Keio代表理事、特定非営利活動法人ケイロン・イニシアチブ理事、一般社団法人海外日本人研究者ネットワーク理事、UJA.Inc(NPO in USA)board memberを務め、若手研究者の支援にも力を入れている。(※所属などはすべて掲載当時の情報です。)
早野研究室HP: https://www.hayano-aging-lab.com/
関連記事Recommend
-

マウスからニワトリ、さらにターコイズキリフィッシュへ。生命の「時の設計図」解明のため、あえてモデル動物を変えていく荻沼チームリーダーの研究戦略
固定観念を覆すpH応答生物学の確立へ
-

尿からmiRNAを捕捉し、ステージ1からがんを早期発見。技術顧問としてのベンチャー共同創業
Craif株式会社 共同創業者・技術顧問 安井隆雄
-

独自のバイオインフォマティクス技術で、世界を変える酵素をデザインする
株式会社digzyme 代表取締役CEO 渡来 直生
-

スキンケアの疲労回復効果を検証!日常に取り入れる「疲労の科学」
~大阪公立大学健康科学イノベーションセンター~
-

「子どもたちを心臓の再手術から救いたい」――。思いを叶えるために根本教授が採ったユーザーイノベーション戦略
心・血管修復パッチ「シンフォリウム®」開発のキーマンに聞く「医師にしかできないサイエンス」とは
-

iPS細胞の実用化に向けた挑戦
京都大学iPS細胞研究財団
-

栄養学の新潮流「時間栄養学」とは? 私たちの健康を左右する、食事と体内時計の密接な関係に迫る!
-

次のパンデミックに備え、社会により貢献できる研究を目指して 慶應義塾大学医学部 感染症学教室 南宮 湖
臨床と研究をつなぎ国際保健に活かす「フィジシャン・サイエンティスト」を実践
-

CRISPR-Cas9の精度を飛躍的に高める「セイフガードgRNA」を開発した、九州大学川又助教の発想法
-

折り紙技術を駆使して宇宙から血管、さらに細胞にも活用。いつも自分で道を切り開いて歩み続ける研究者、繁富(栗林)准教授