リケラボは研究者、研究開発・技術職など理系の知識を生かしてはたらきたい人を応援する情報サイトです。

遺伝子組換え技術には既に半世紀の歴史があり、数多くの組換え作物やバイオ医薬品などが作られてきました。ただ従来の技術では精度が高くないうえ、膨大な時間と手間が必要でした。これを解消したのが米国で開発されたゲノム編集ツールCRISPR-Cas9です。しかしながらCas9は特許権をめぐって係争中であり、産業利用が難しい状況です。そこで真下知士教授らのグループは、新たにCRISPR-Cas3を開発しました。Cas9とは異なるメカニズムに基づくCas3は、ゲノム編集に新たな可能性を拓く日本発の技術です。本稿ではこの技術を開発した東京大学・真下教授にゲノム編集の現状と今後の展望、バイオサイエンスひとすじの研究者人生と、その究極の夢を教えていただきました。
遺伝子組換えからゲノム編集への進化
遺伝子組換えとゲノム編集、用語が2つありますね。
真下:遺伝子組換えは、1970年代から使われ始めた技術です。例えば、農業分野では「遺伝子組換え作物」がいくつも作られています。あるいはバイオ医薬品も実用化されています。例えばヒトのインスリン分泌に関わる遺伝子を取り出して大腸菌に組み込めば、大腸菌がヒトのインスリンを分泌するようになります。これはバイオ医薬品として糖尿病の治療に使われています。これらはいずれも遺伝子組換え技術によるものであり、その延長線上にあるのがゲノム編集です。
基本的な考え方は同じ、ということでしょうか。
真下:そのとおりです。そもそも遺伝情報とは、DNAを構成する4種類のデオキシリボヌクレオチドの塩基の並び方を意味します。A(アデニン)、T(チミン)、G(グアニン)、C(シトシン)が数珠つなぎの二重らせん構造となっているのがDNAです。この塩基の並び方を変えるのが、遺伝子組換え技術でありゲノム編集です。ただ「組換え技術」が「編集」に進化し、効率が数千倍から数万倍に高まりました。
そこまで効率が変わるのは、何かが決定的に違うのですね。
真下:以前の遺伝子組換えは、外部から遺伝子を導入して配列を変えます。例えば医学の実験用動物として使われるノックアウトマウスとは、特定の遺伝子を破壊し、その結果として病気が発症するかどうかをみるものです。ただ、特定の遺伝子を破壊しても思い通りの結果が得られるとは限りません。偶然に頼る必要があるため1匹のノックアウトマウスを作るのにも、遺伝子組換え技術では同じ作業を何度も繰り返す必要がありました。
これに対してゲノム編集では、DNAの狙ったところを切ってDNAの並び方を変えます。その編集ツールとして始めて1996年に開発されたのがジンクフィンガーヌクレアーゼ(ZFN)、続いてTALEヌクレアーゼ(TALEN)が開発され、そしてよく知られているのが2012年に誕生したCRISPR-Cas9です。
CRISPR-Cas9の特長と課題
CRISPR-Cas9とは、具体的にどのようなツールなのでしょうか。
真下:例えるなら遺伝子を切る「ハサミ」です。二重鎖のDNAに対して、ピンポイントで狙ったところだけを切れるのです。切られたDNAは元に戻ろうとします。その修復の際には、切れた部分のまわりの塩基配列が失われる「欠失」、新たな塩基配列が加わる「挿入」、それまでとは異なる塩基配列に入れ替わる「置換」のいずれかが起こります。いずれにしても元の塩基配列とは変わる、すなわち遺伝情報が書き換えられるわけです。遺伝子を組替えるツールとして先に開発されていたツールZENやTALENは、タンパク質をつくらなければならないのが難点でしたが、CRISPR-Cas9ではRNAを使います。RNAは誰でも簡単に作成できるのです。
DNAを構成する塩基配列は30億もありますが、遺伝情報はそのうちのごく一部だと聞きました。
真下:タンパク質を作るのに関わる領域は、30億の1%といわれています。従ってCRISPR-Cas9が狙うのも、この1%の内のどこかです。もっとも最近の研究では、残りの99%も何らかの役割を果たしている可能性が指摘されています。
CRISPR-Cas9はアメリカで開発され、知財を巡る争いが起きているそうですね。
真下:CRISPR-Cas9の最初の発明者は、米カリフォルニア大学バークレイ校のジェニファー・ダウドナ教授と、その共同研究者エマニュエル・シャルパンティエ博士らのチームと考えられていました。彼女たちが研究成果を発表したのが、2012年6月の『Science』誌です。当然、特許申請手続きも同時に進めていました。ところが先に特許を取得したのは、米ブロード研究所のフェン・ツァン博士だったのです。そこで知財を巡る争いが起こり、未だに決着はついていません。学術的な研究目的でCRISPR-Cas9を使う分には、今のところ問題はありません。ただ産業用途で利用する場合には、ダウドナ教授チームあるいはツァン教授チームのどちらが勝つにせよ、特許の使用料が発生する可能性があり、その金額は莫大な額になると推測されています。

研究成果を社会に還元するために設立したベンチャー「C4U株式会社」のラボにて、研究員との打合せ。
日本で開発された、より使いやすいCRISPR技術
そもそもCRISPRとは、どういう意味なのでしょうか。
真下:CRISPRとは「Clustered Regularly Interspaced Short Palindromic Repeat(一定の間隔を空けて配置された短い回文の反復)」を略したものです。1987年に、大腸菌のDNAの中に同じ塩基配列が繰り返し並んでいることが発見されました。発見者は当時、大阪大学微生物病研究所におられた石野良純教授(現・九州大学教授)らです。
それにCasが付くと何か特別な意味が生まれるのですね。
真下:CRISPRの塩基配列の近くには、必ず遺伝子が存在します。この遺伝子がCas(CRISPR-associated)と名付けられました。そしてCRISPR-Casが、大腸菌などの細菌が持っている免疫システムであることもわかりました。細菌に感染するウイルスなどのゲノムを切断することで、細菌は自らを守るのです。だから細菌が異なれば、持っているCRISPR-Casも違ってきます。Casの種類により、Cas1から現時点ではCas14までが見つかっています。CRISPR-Cas9は9番目に見つかったCasというわけです。そして、CRISPRの中でもCas9がゲノム編集に使えそうだとわかってきたのが2010年ぐらいで、先ほどの発見に至ったわけです。
ということはCas3の方が、先に見つかっていたのですか。
真下:そのとおりです。そしてCas3を使ってもゲノム編集をできるのではないかと、2016年から大阪大学微生物研究所の竹田潤二招へい教授が始めた研究に、私も参加しました。ところがCas3では、Cas9のようにゲノムを切ることができなかったのです。Casシステムでは、Casタンパク質とガイドRNAが複合体となって作用します。ポイントは、このガイドRNAが成熟型であることです。ところが、あるとき実験を担当していた学生が、たまたま成熟型RNAではなく、その前段階の未成熟なRNAを使ったところ、Cas3でゲノム編集ができてしまったのです。
偶然の結果を見逃さなかったのですね。
真下:誰もやらないことをやったときに思わぬ成果が出るのは、科学の歴史上何度も繰り返されてきたことですが、同じ幸運も我々も見逃さなかったといえます。そして、なぜ成熟型RNAではなく未成熟なRNAでゲノム編集をできたのか。そのメカニズムを徹底的に追究した結果が、CRISPR-Cas3に関する私たちの知財につながったのです。
ハサミではなくシュレッダー
Cas9とCas3は、どのように違うのでしょうか。
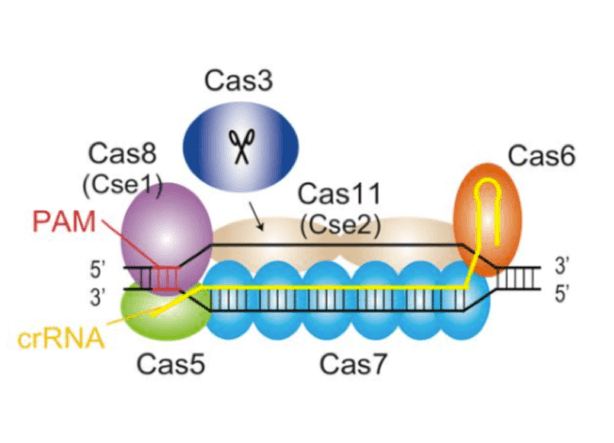
真下:Cas9をハサミと例えましたが、Cas3はシュレッダーといえばわかりやすいでしょう。Cas9がピンポイントで切るだけなのに対して、Cas3はゲノムをごそっと切り取って変えることができます。CRISPR-Casシステムは、複数タンパク質の複合体でDNAを切断するClass1と、1つのタンパク質で切断するClass2に分けられます。Cas9はClass2であり、Class1でのゲノム編集技術は、これまで報告されていませんでした。
つまり、まったく新しいゲノム編集技術を開発した。
真下:Cas9との重要な違いは、Cas3を開発したのは我々だということ。これは日本発の技術であり特許も日本で取得済み、国際特許も出願しています。産業利用してもCas9で想定されるような膨大な特許料を心配する必要はありません。しかもCas9でできることは、たいていCas3でもできます。さらにCas9とは違ってゲノムを大きく削ることができるので、ゲノム領域を丸ごと変えてしまうような遺伝子治療に使える可能性もあります。
Cas9ではオフターゲットの問題が指摘されますが。
真下:狙ったところとは違う場所のゲノムを切ってしまう、いわゆるオフターゲット問題については、我々もCas3の安全性を確かめるための実験を繰り返しています。まだ確定的な話はできませんが、現時点で取れているデータでは、オフターゲットが起こる確率は、Cas3の方がCas9と比べて少ないようです。
活用の可能性がどんどん広がりそうですね。
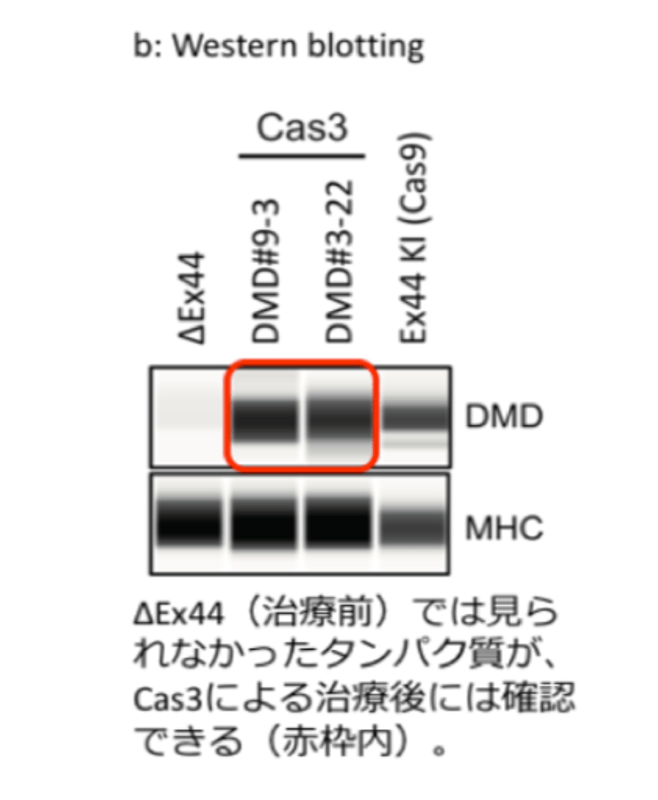
真下:最近話題になっているガンの新たな治療法CAR-Tでも、CAR-Tにゲノム編集を加えることでより活性化し、効率的な治療を行える可能性があります。また、今のところCAR-Tの対象となるのは血液のガンですが、これをゲノム編集により他のガンに対しても効かせる可能性も出てきます。さらにはiPS細胞にゲノム編集を加えた治療なども考えられます。実際にCRISPR-Cas3を使ってデュシャンヌ型筋ジストロフィー遺伝子に変異を持つ、ヒトiPS細胞の遺伝子修復にも成功しました。この研究成果は、英国科学誌『Nature Communications(オンライン)』で2019年12月6日に公開されています。
バイオサイエンスに引き寄せられた人生
大学入学時は農学部だったそうですね。
真下:ちょうど大学受験の頃にバイオサイエンス、分子生物学などが注目され始めました。こうした学問を求めて農学部に入りましたが、残念ながら少しあてが外れました。そこで学部4回生のときから医学部の動物実験施設に関わるようになったのです。ただし、当時は医学研究科に入るためには修士を取らなければなりません。そこでできたばかりの人間環境学研究科で医学部の先生から学びました。
医学にも関心を持っていたのですか。
真下:学部4回生で医学部に関わったときから、ヒトの病気と治し方に興味を持つようになりました。そして人間・環境学で学位を取り、フランスのパスツール研究所に留学します。パスツールでは主にマウスの遺伝学に取り組み、日本で京都大学に戻って今度はラットの遺伝子研究、組換え研究をやるようになったのです。これが結局、今のゲノム編集につながっています。その後、大阪大学に呼んでもらい、今度は東京大学に呼ばれました。
ベンチャー起業もしています。
真下:C4U、つまりCRISPR for Youを意味する社名のバイオベンチャーです。我々が開発したCRISPR技術は、みんなのためのものです。特にC4Uでは医療用途としてのCas3技術の普及に努めます。
Cas3を広め深めて、究極の夢の実現へ
Cas3は、知財の問題も明確にクリアした日本発の技術として広がりそうですね。
真下:そうなってくれることを願っています。Cas3で一人でも多くの人を救うこと、これが私の重要な使命と心得ています。一方でCas3の可能性を徹底的に掘り下げてみたい。動物を使ったゲノム編集により、いわゆる「ヒト化動物」、つまり遺伝子や細胞・組織の一部を人間のものに置き換えたヒトの疾患モデルとなる実験用の動物を作りたい。これが究極の夢です。実現すれば、医療を飛躍的に進歩させることにつながるはずです。
研究ひとすじで歩んできた人生を振り返ってみて、いちばん大切なことは何でしょうか。
真下:やはり知的好奇心に尽きると思います。これがあるから研究を続けたいと思う。もちろん簡単にできることではないけれども、何かを発見したときの喜びは、筆舌に尽くしがたいものがあります。この喜びを味わうために研究に打ち込んでいるのです。
好きなことに打ち込めるのは、幸せな職種ですね。
真下:研究に興味のある人は、ぜひ研究者を目指してほしい。博士の待遇を政府が見直すというニュースを、つい最近見かけました。学位を取ることとは、自分で研究を考えて組み立てる能力のあることを意味します。ものごとを俯瞰的に見つめて、全体像を把握しないと研究はできません。そうした能力を身につけるのが、博士課程だと思います。その力は他の分野でも応用が効きます。
先生がベンチャー起業されたのも、その一例だと。
真下:博士たちの活躍の場としても、ベンチャー企業が果たす役割は大きいと思います。実際に、学位をとって起業する若い研究者たちも増えているようです。博士号を持つ人たちが活躍できる場、そのモデルにC4Uがなるよう頑張っていきたいと思っています。
東京大学医科学研究所 実験動物研究施設 先進動物ゲノム研究分野 教授
真下 知士(ましも ともじ)
1994年、京都大学農学部卒業後、京都大学大学院医学研究科附属動物実験施設研究生、97年、京都大学大学院人間・環境学研究科文化・地域環境学専攻修士課程修了、2000年、同博士課程修了、博士(人間・環境学/京都大学)。フランス・パスツール研究所免疫学講座ポスドク研究員を経て、2003年、京都大学大学院医学研究科附属研究施設産学連携研究員、同特定准教授を経て、2015年、大阪大学大学院医学系研究科附属動物実験施設准教授、2019年より東京大学医科学研究所実験動物研究施設先進動物ゲノム研究分野教授(※所属などはすべて掲載当時の情報です。)
関連記事Recommend
-

【睡眠研究】人類に必要なのは冬眠…?冬に起きられない理由【動画で解説】
-

マウスからニワトリ、さらにターコイズキリフィッシュへ。生命の「時の設計図」解明のため、あえてモデル動物を変えていく荻沼チームリーダーの研究戦略
固定観念を覆すpH応答生物学の確立へ
-

尿からmiRNAを捕捉し、ステージ1からがんを早期発見。技術顧問としてのベンチャー共同創業
Craif株式会社 共同創業者・技術顧問 安井隆雄
-

独自のバイオインフォマティクス技術で、世界を変える酵素をデザインする
株式会社digzyme 代表取締役CEO 渡来 直生
-

スキンケアの疲労回復効果を検証!日常に取り入れる「疲労の科学」
~大阪公立大学健康科学イノベーションセンター~
-

「子どもたちを心臓の再手術から救いたい」――。思いを叶えるために根本教授が採ったユーザーイノベーション戦略
心・血管修復パッチ「シンフォリウム®」開発のキーマンに聞く「医師にしかできないサイエンス」とは
-

iPS細胞の実用化に向けた挑戦
京都大学iPS細胞研究財団
-

栄養学の新潮流「時間栄養学」とは? 私たちの健康を左右する、食事と体内時計の密接な関係に迫る!
-

次のパンデミックに備え、社会により貢献できる研究を目指して 慶應義塾大学医学部 感染症学教室 南宮 湖
臨床と研究をつなぎ国際保健に活かす「フィジシャン・サイエンティスト」を実践
-

CRISPR-Cas9の精度を飛躍的に高める「セイフガードgRNA」を開発した、九州大学川又助教の発想法