CRISPRとは
CRISPRとは
さまざまな生命現象をDNA、RNA、タンパク質などの生体分子のレベルで研究する分子生物学は、1953年にDNAの二重らせん構造が発見されたことなどをきっかけに急速に発展してきました。2010年代前半、そんな分子生物学分野において、世界中の研究者の研究手法を変えてしまうほど重要な発見がありました。それが「CRISPR」です。CRISPRは生物の特定のゲノム配列を切断し、改変するツールの実現につながったのです。
発見当初は機能が分からなかったCRISPRは、後の研究によって細菌やアーキアにおける獲得免疫機構として働くことが明らかになりました。さらに、CRISPRの免疫機構の1つであるCRISPR−Cas9システムは、さまざまな生物におけるゲノム編集ツールとして使えることが分かり、研究者の注目を集めることになります。CRISPRを使ったゲノム編集技術の開発に貢献したエマニュエル・シャルパンティエとジェニファー・ダウドナは2020年にノーベル化学賞を共同受賞しました。
ここでは2010年以降の分子生物学に大きな影響を与え続けているCRISPRの細菌やアーキアにおける獲得免疫機能、そしてゲノム編集ツールとしてのCRISPRについて紹介します。
CRISPRの発見
CRISPRは細菌やアーキア(古細菌)が持つゲノムに見られるDNA配列の特定領域です。clustered regularly interspaced short palindromic repeatの略称で、日本語訳すると、クラスターを形成し規則正しい間隔(スペーサー配列)を持つ短いパリンドロームリピートとなります。パリンドロームというのは、-GAATTC-や-CGCGCG-などの塩基配列のことでDNAが2本鎖になったときに点対称になっている配列を意味します。
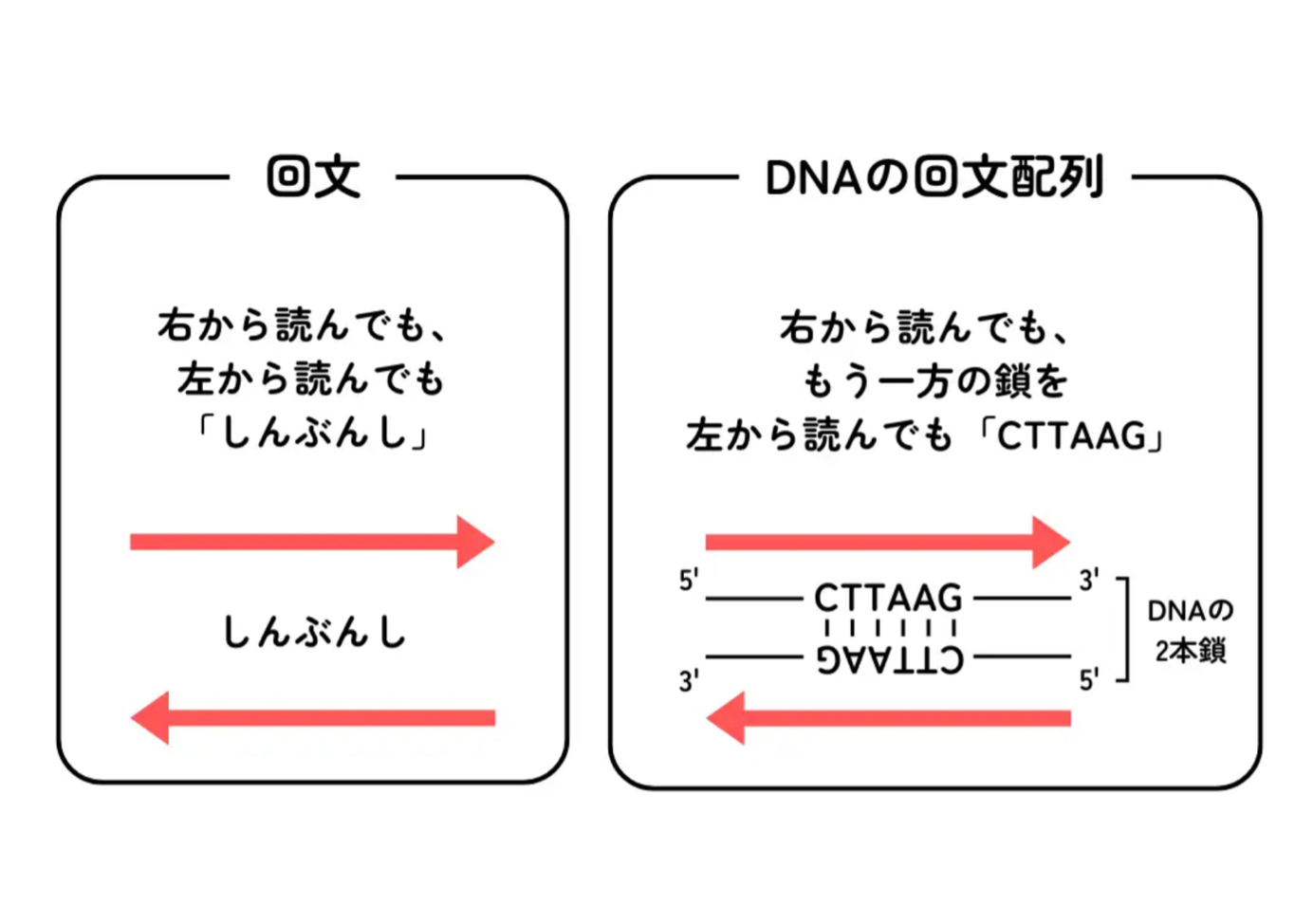
CRISPRの最初の発見者は日本人の石野良純でした。博士論文をまとめた後に始めた大腸菌のリン酸代謝制御の研究の中で、石野は独特なDNA配列の繰り返しを発見します。2つのパリンドロームを含む29塩基の共通配列が一定の間隔をおいて何度も繰り返されているその配列は、石野にとって、これが偶然の産物ではなく何か意味があるもののように思えたそうです。1987年に世界で初めてこの配列が報告された後、それは他の細菌やアーキアなどにも見られることが分かり、CRISPRと呼ばれるようになりました。2015年時点で全ゲノム配列が明らかになった細菌の中では50%、アーキアの中では90%がCRISPRを持っているとされています。
細菌の免疫機構を担うCRISPR
CRISPRが細菌やアーキアの免疫機構として機能することが分かってきたのは2000年に入ってからです。細菌やアーキアはファージ(細菌に感染するウイルス)やプラスミドなどの外来核酸の侵入に常にさらされており、それらの脅威に対処するために独自の武器を進化させてきました。分子生物学のツールとしてなくてはならない制限酵素もその例の1つです。制限酵素はDNAの特定の配列を認識し切断することで外来核酸の侵入に対応することができます。しかし、特定の配列のみに作用するためその機能は限定的です。一方でCRISPRはより柔軟で強力に外来核酸に対応できるものでした。
<CRISPRによる獲得免疫機構>
CRISPRの働きは、ヒトの免疫機構によく似ています。違いは、記憶するものが抗原(アミノ酸配列)なのかDNA配列の情報なのかです。以下詳しく説明します。
ヒトは一度ウイルスや細菌などの病原体に感染し回復すると、体の中に免疫が獲得されます。これにより、次に同じウイルスや細菌が体内に侵入してきた場合、より効率的に対応できるようになります。ヒトにおける獲得免疫機構のポイントは、最初の感染で病原体の表面にある抗原に関する情報が免疫システムに記憶されることにあります。
CRISPRの場合は、細胞内に侵入してきた外来核酸(DNAやRNA)の配列情報を記憶します。この時重要なのが、Casタンパク質(CRISPR-associated proteins)です。CRISPRはCasタンパク質とともに働くことで、このヒトにおける獲得免疫機構と似たような働きをします。Casタンパク質は、免疫のプロセスに応じて異なる種類が働きます。
外来核酸の情報は、Casタンパク質の機能により、CRISPR配列中のスペーサー配列としてゲノム配列中に保存されます。保存された外来核酸の情報は、次に同様の核酸が細胞内に侵入してきた際に、それを見分ける目印のように機能します。それをもとに、核酸を切断する機能を持つCasタンパク質が導かれ外来核酸を切断します。
<CRISPR−Casシステムによる外来核酸への対応の流れ>
以下流れを追って説明します。
1. 外来核酸のCRISPR内への取り込み
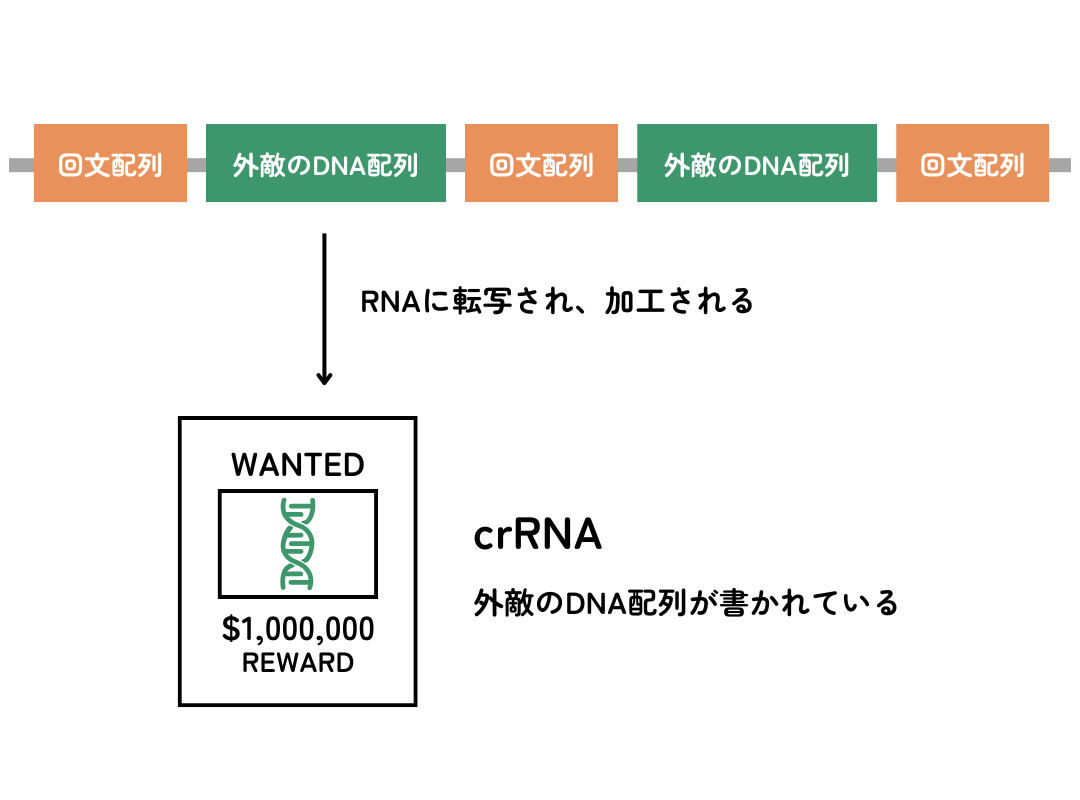
細胞内に侵入した外来核酸はCas1-Cas2タンパク質複合体の働きにより断片化されます。断片化された外来核酸は、新たなスペーサー配列としてCRISPRに取り込まれます。この機構による取り込みは必ずしも1対1で対応しているわけではなく、CRISPRのスペーサー配列には複数の外来核酸から由来する情報が格納されている場合が多くあります。
2. CRISPRの発現
次に同じ外来核酸が侵入したとします。その際、まずCRISPR領域全体が一本のRNA(pre-crRNA)として転写されます。このときRNA中には複数のスペーサー配列が含まれますが、プロセッシング(※)により1つのスペーサー単位に分割されます。1つのスペーサー単位に分割されたRNAのことをcrRNAと呼びます。
※プロセッシング:複数の情報を持つ長いRNAがそれぞれの情報ごとに断片化されること。
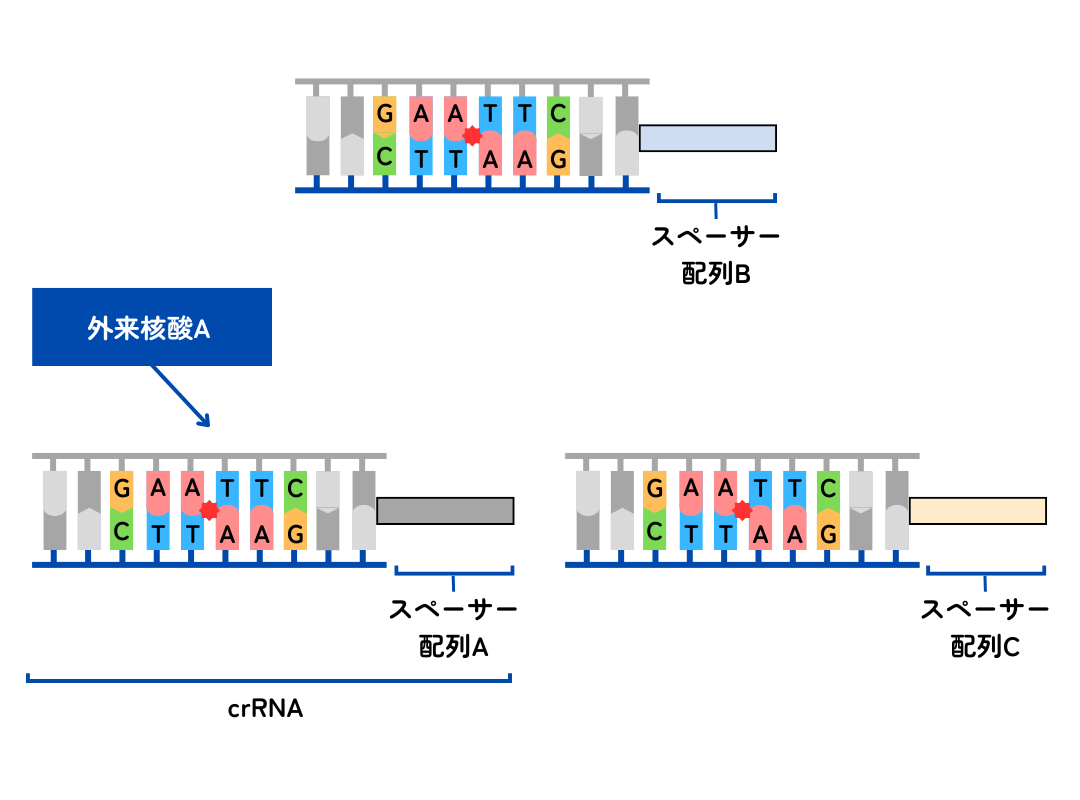
3. 外来核酸の切断
crRNAは核酸を切断する機能を持つCasタンパク質(Cas3以降のどれか)と複合体を形成します。複合体中のcrRNAが自身のスペーサー配列と相同な塩基配列を持つ外来核酸を認識し、相補的結合をつくります。Casタンパク質が外来核酸を切断しその機能を無効化することで、免疫としての機能を発揮します。
CRISPR-CasシステムはⅠ〜Ⅲ型に分類されます。Ⅰ型とⅢ型は大きなCasタンパク質複合体を形成し外来核酸を切断します。一方、Ⅱ型はcrRNAとtracrRNA(crRNAの特定領域と相補的な配列を持つRNA)とCas9タンパク質が複合体を形成し外来核酸を切断します。
ゲノム編集ツールとして広く使われているCRISPR-Cas9
ゲノム編集の基本原理として、まず標的となるDNA配列を切断しなければなりません。この切断に、CRISPRの外来核酸を切断する機能を利用します。(ゲノム編集の原理については別項用語集「ゲノム編集」をご参照ください)
2012年にシャルパンティエとダウドナらが、CRISPR-Cas9を用いて、試験管内で標的DNAを切断できることを実験で証明し、ゲノム編集ツールとして世界中に広まりました。
Ⅱ型のCRISPR-Cas9システムが使われるようになったポイントは、核酸の認識方法にあります。このシステムでは、crRNA、tracrRNA、Cas9タンパク質が働きます。まずcrRNAとtracrRNAが結合し2本鎖RNA(crRNA:tracrRNA)を作ります。このとき、crRNA側が標的となるDNA配列を認識し、tracrRNA側がDNAの2本鎖を切断するCas9タンパク質が結合する場所となります。つまり、DNAの切断部位を決めるのはcrRNA:tracrRNAということになります。このcrRNA:tracrRNAは人工的に作ることが可能だったためCRISPR-Cas9システムがゲノム編集ツールとして広まることになりました。人工的に作ったcrRNA:tracrRNAはsingle-guide RNA(sgRNA)と呼ばれます。
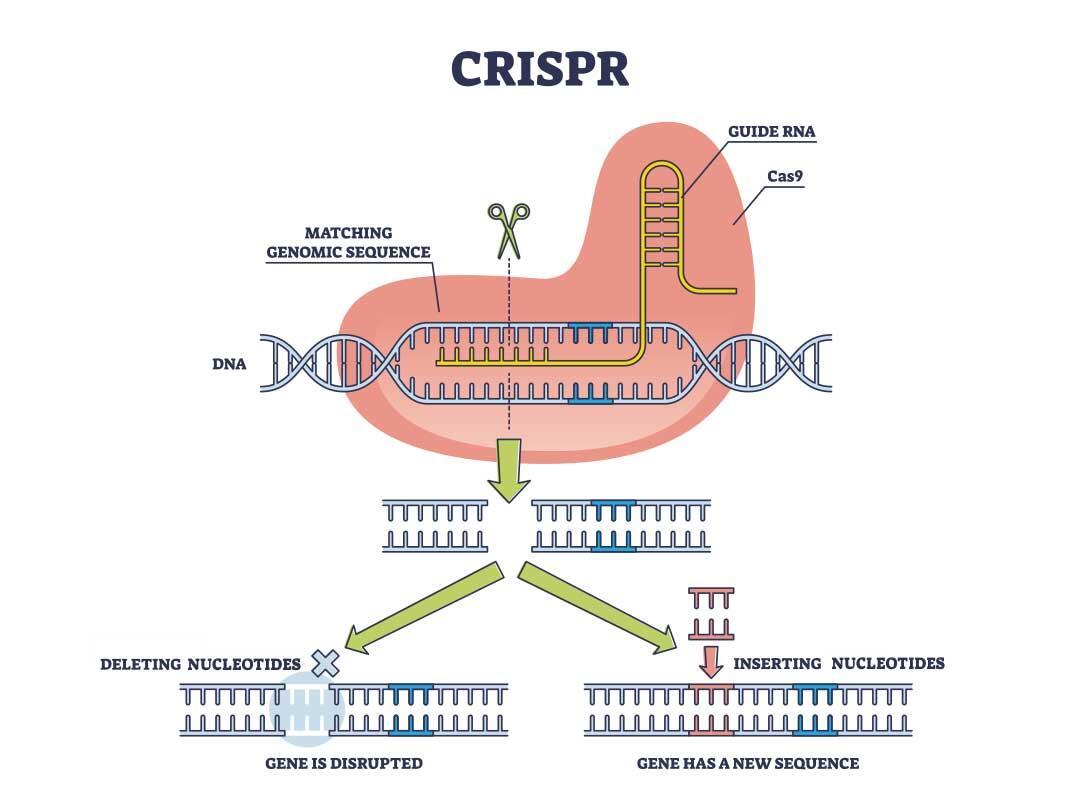
CRISPR-Cas9システムのように、ゲノム中の任意のDNA配列を削除、置換、挿入する遺伝子改変技術はゲノム編集技術と呼ばれます。これまでにZFN、TALENといったゲノム編集ツールが開発されていましたがその運用はコストや時間がかかるものでした。一方でCRISPR-Cas9システムはその2種より遥かに簡単に運用することができたため、ゲノム編集技術の普及に一役買うこととなりました。ポイントとなったのは、DNA配列の認識機構です。CRISPR-Cas9システムでは上述の通り、標的DNAの認識にはRNAが使われます。ZFNとTALENにおいては同様の機能をタンパク質が行います。RNAとタンパク質を比較するとRNAの方が設計や合成が容易だったのです。
まとめ
日本人の研究者が初めて見つけたゲノム中のDNAの繰り返し配列であるCRISPR配列。当時は機能未知だったものが、細菌やアーキアに見られる独自の免疫システムだったことが分かりました。さらにはそのシステムの一部であるCRISPR-Cas9は現在では分子生物学の研究や応用においても欠かせないゲノム編集ツールとなっています。
一方で、CRISPR-Cas9にも課題があることが知られています。例えば目的のDNA配列とは異なる部分を切断してしまうオフターゲット効果があります。これらの課題をクリアするためにさまざまな方法の研究が進められています。またCas9以外のCasタンパク質を使うゲノム編集法の研究も進められています
(参考記事:「Cas9がハサミなら、Cas3はシュレッダー」革新的なゲノム編集技術CRISPR/Cas3を開発した真下教授、その究極の夢とは)
今後のCRISPRの研究、CRISPRを使った応用に注目です。
記事執筆:吉田拓実(東京大学大学院 農学生命科学研究科 博士課程修了 博士(農学)/ 再考編集室 編集記者 / さいこうファーム 農場長)
(上記すべて参照:2025-2-21)