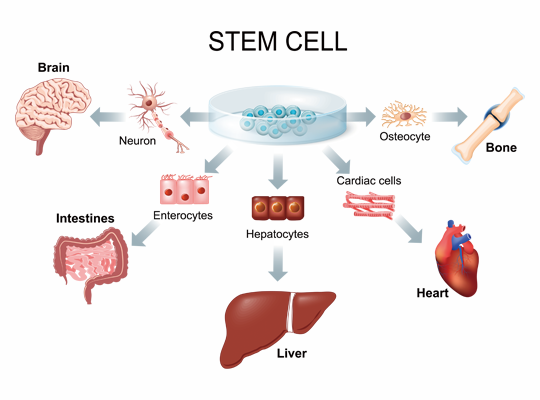
ゲノム編集とは
ゲノム編集とは、生物のゲノム中の特定のDNA配列を狙って編集する技術のことです。
ゲノムとは、ある生物の遺伝情報を含むDNAの全体のことを意味します。ゲノム編集では、人工の酵素や人工的に細工した酵素を用いて、ゲノム中の特定のDNA配列に対して欠損や置換、もしくは新たなDNA配列の挿入を行います。
ゲノム編集技術はさまざまな分野で応用が始まっています。例えば農業の分野では狙った形質を持つ作物を生み出す品種改良の効率を劇的に向上させることが可能になりました。
従来の品種改良は、栽培の過程で突然変異によって良い形質を手に入れた作物種を選抜したり、性質の異なる品種をかけ合わせて良い形質を持つ種を選別したりして進められました。その他にも放射線(X線)を使ってランダムに遺伝子変異を入れることで望ましい形質を持つ種を選別する方法もあります。どの方法を用いる場合でも、良い品種を手に入れるためには適切なDNA配列に偶然遺伝子変異が起きる必要があります。そのため、長い時間をかけて少しずつ進められるものでした。一方でゲノム編集技術を用いると狙った遺伝子を直接操作することができるため、偶然に頼らずに、より効率よく品種改良を進めることができるようになったのです。
ここでは、私たちの世界にすでに大きな影響を及ぼし始めているゲノム編集の基本原理、歴史、応用、そして現在議論されている問題などについて紹介します。
ゲノム編集の基本原理
ゲノム編集に使えるツールとして知られているものにはZFN(Zinc-finger nuclease)、TALEN(transcription Activator-Like Effector Nucleases)、CRISPR-Cas9の3種類があります。どのツールにおいても基本原理は共通です。重要なのは特定のDNA配列を認識することと、認識した配列に基づきDNAの二本鎖を切断することです。
<ゲノム編集の基本原理>
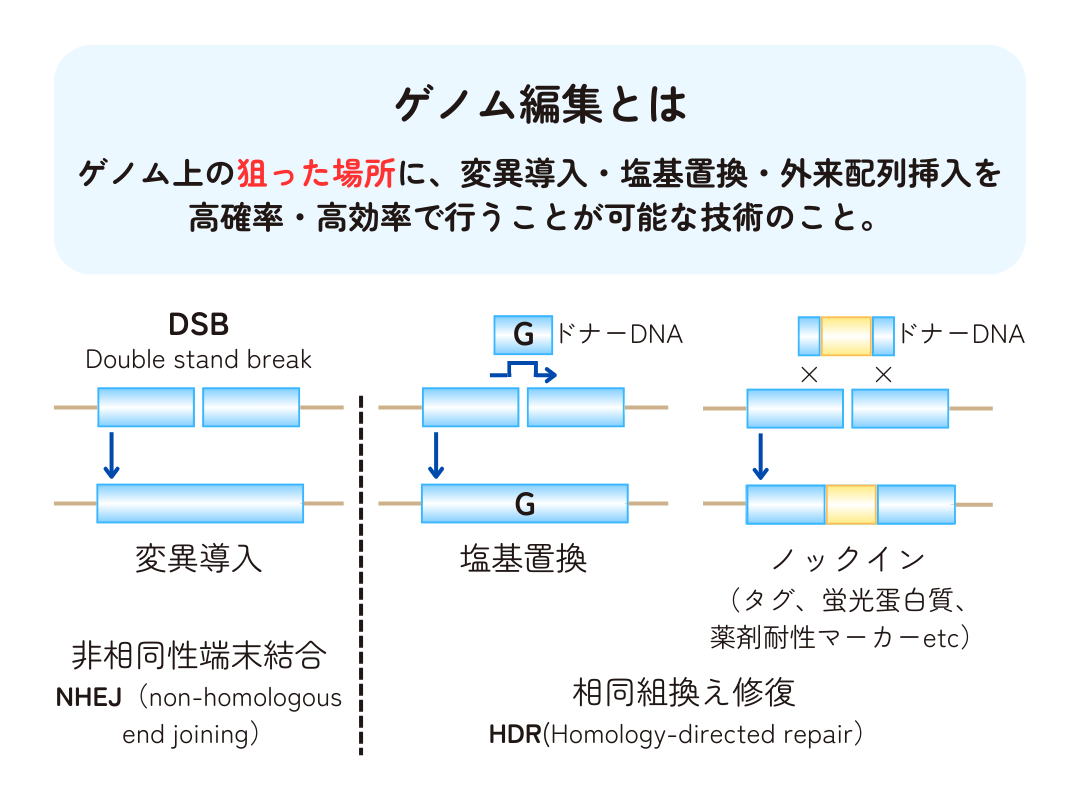
- ゲノム中の改変したい部位のDNA配列を認識し、DNAを切断するタンパク質(酵素)をガイドするための分子を導入する。配列を認識する分子はタンパク質やRNAの場合がある。
- DNAを切断するタンパク質により、標的となるDNA配列に二本鎖切断(DSB; double-strand break)を引き起こす。
- 切断されDSBが生じたDNAは、細胞が持つ修復機構により修復される。代表的な修復機構は非相同性末端結合(NHEJ; non-homologous end joining)または相同組換え修復(HDR; homology directed repair)の2つ。
- NHEJはDNAの切断部の端と端を直接つなげて修復する機構で、修復時にDNA配列の欠損や余計なDNA配列の挿入などのエラーが生じることがある。一方のHDRは切断部位と相同な配列を持つDNAを鋳型にして修復する。鋳型となるDNAは通常の修復機構の場合、同じ遺伝子を持つ対となる染色体のDNAを鋳型とするが、ゲノム編集では外部から鋳型となるDNA配列を導入する。
- NHEJやHDRによるDNA配列の欠損、挿入、置換により、元のDNA配列が改変され、特定の部位のゲノム編集が達成される。
ゲノム編集技術の変遷
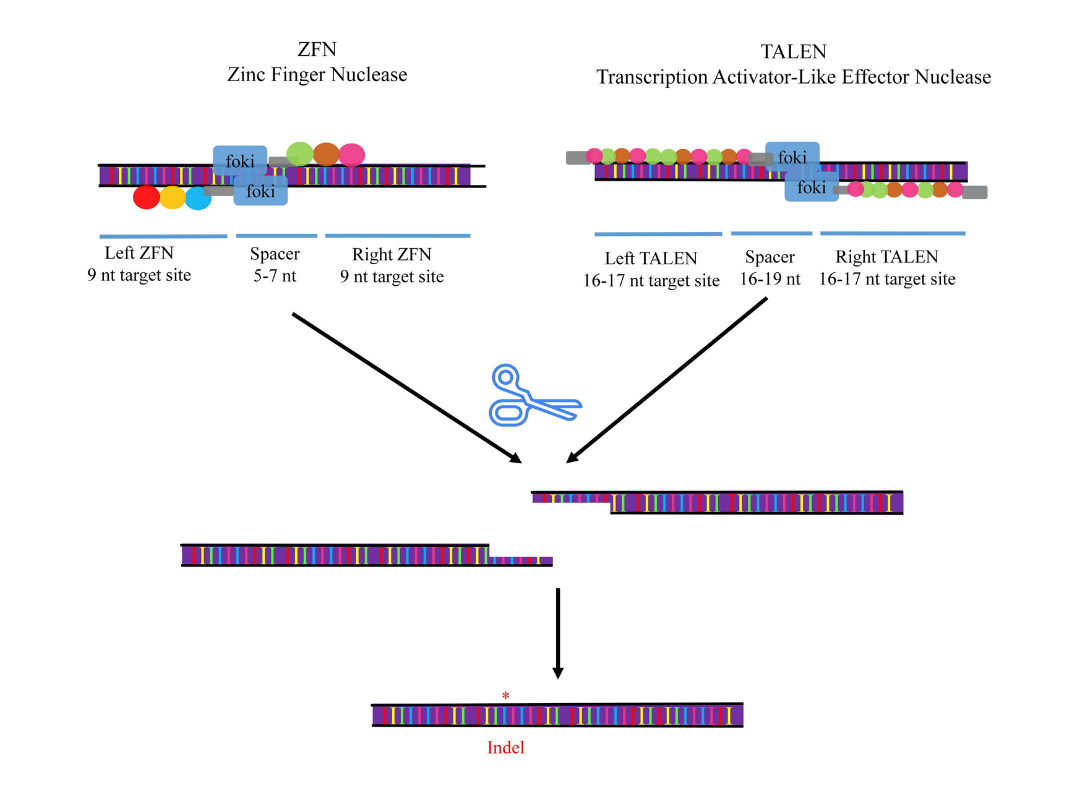
ZFN、TALEN、CRISPR-Cas9の3種類のゲノム編集ツールのうち、一番最初に開発されたのはZFNでした。
ZFNが最初に報告されたのは1996年です。ZFNでは標的DNAの認識にZinc-fingerという、タンパク質の配列の一部(アミノ酸配列)で、決まったDNA配列に特異的に結合する部分(DNA結合ドメイン)を使います。Zinc-fingerは、認識するDNA配列に応じて数多くのパターンが存在し、人工的に設計することも可能です。
DNAの切断には、Fok1という酵素を使います。(制限酵素の一つで、細菌が持つタンパク質の一種で、決まったDNA配列を特異的に切断します。)
これらを結合させたタンパク質を人工的に合成し、できるのがZFNです。
ZFNの開発により、初めてゲノム編集が可能となりました。しかし、DNA結合ドメインのZinc-fingerの設計が煩雑なことからその利用は限定的でした。
次に登場したのはTALEN(Transcription Activator-Like Effector Nuclease) です。
TALENは2010年に報告されます。ZFNと同様に標的DNAの認識機能とDNAの切断機能を持つ人工酵素によりゲノム編集を行います。DNA切断機能は、ZFNと同じ制限酵素Fok1が使われています。一方で標的DNAの認識については、植物病原細菌のキサントモナス属が持つTALEというDNA結合ドメインが使われました。TALEはZinc-Fingerに比べ、DNA配列を認識する機構がより正確なため、切断特異性も高くなりました。
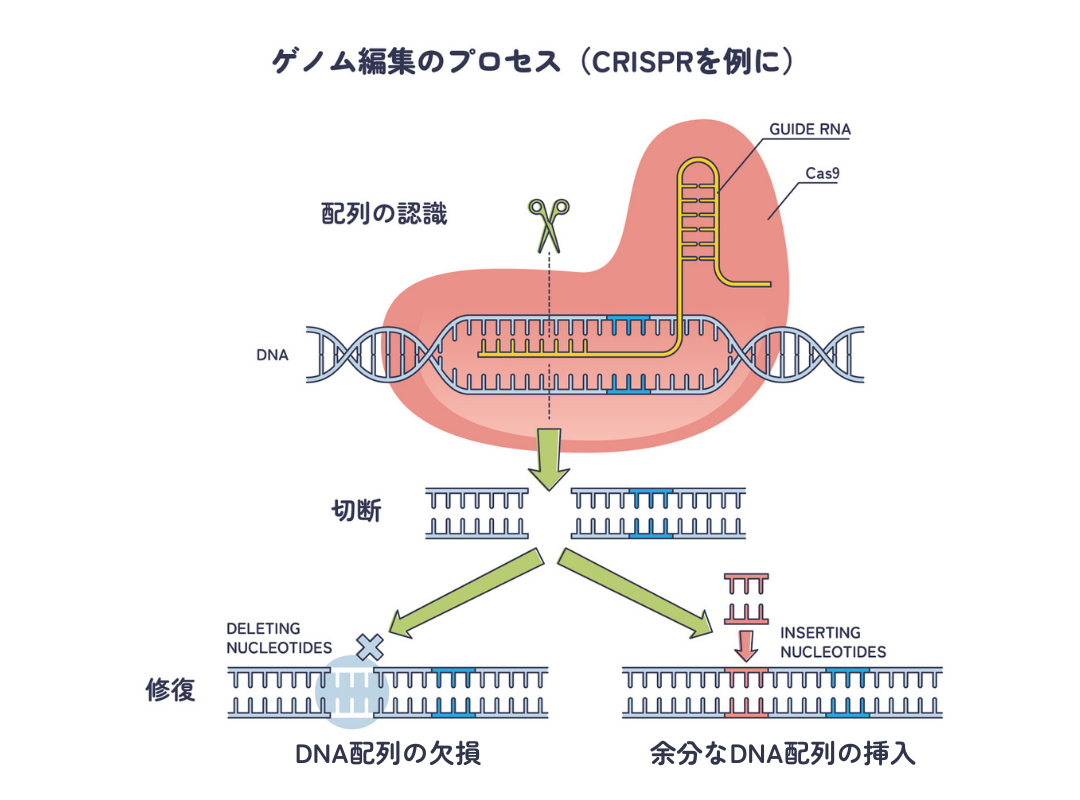
しかし、依然として煩雑さが伴うものでした。その状況を一変させたのがCRISPR-Cas9です。
CRISPR-Cas9によるゲノム編集は、TALENの報告のわずか2年後の2012年に報告されます。CRISPR-Cas9は細菌やアーキア(原始的な細菌)の獲得免疫機構として発見されたものです。ZFNやTALENはタンパク質(アミノ酸配列)によって標的DNAを認識していましたが、CRISPR-Cas9では、RNAを使って標的DNAを認識します。ガイドとなるRNAにより標的部分に導かれたCas9タンパク質がDNAを切断します。
RNAはタンパク質(アミノ酸配列)よりも設計や作製が容易なため(RNAとタンパク質の違いについてはセントラルドグマの解説もご覧ください)、ZFNやTALENよりも格段に簡単にゲノム編集を実現できるようになりました。CRISPR-Cas9の開発に貢献したエマニュエル・シャルパンティエとジェニファー・ダウドナは2020年にノーベル化学賞を受賞しています。詳しくは別稿CRISPRを参照ください。
ゲノム編集の応用
ゲノム編集技術は、現在では基礎研究はもちろん、創薬、医療、農畜水産業などさまざまな分野において利用されています。
<基礎研究の発展>
基礎研究では、遺伝子を操作したモデル生物を用いることで生命現象への理解が進みます。ゲノム編集技術の進展により、モデル生物の作製が容易になりました。
動物でのゲノム編集は受精卵や受精前の卵母細胞にゲノム編集ツールを導入することで達成されます。例えば特定の遺伝子を破壊したマウスの作製は、それまでES細胞(胚性幹細胞)を使って1年近くかけて実現していましたが、CRISPR-Cas9により数ヶ月から半年で実現できるようになりました。
植物においては、細胞壁という硬い組織を持つため、ゲノム編集ツールを直接導入することは困難です。そのため一度、従来から使われているアグロバクテリウム法などの遺伝子組み換え方法により、植物のゲノム配列中にゲノム編集ツールをつくる遺伝子を組み込みます。組み込まれたゲノム編集ツールの遺伝子からゲノム編集に使われるタンパク質が作られ、そのタンパク質の機能によりゲノム中の特定のDNA配列に変異を加えることができます。また、ゲノム編集作物と日本で呼ばれるものは、DNA配列の改変後に同種の植物との交配を行い、導入したゲノム編集ツールの遺伝子が取り除かれたものを選抜します。
その他にもこれまで難しかった、複数遺伝子の同時改変や同じ染色体上にある複数遺伝子の破壊もゲノム編集ツールによりできるようになりました。
<創薬への応用>
新薬の開発成功率を高めるためには、各疾患における治療ターゲットを分子レベルで知ることが必要です。そのために使われるのが病態を反映したモデル細胞やモデル動物です。
ゲノム編集を用いることによって短時間で多くのモデル系を構築することが可能になりました。
<医療への応用>
ゲノム編集による遺伝子治療の研究も進められています。遺伝子治療は、体外ゲノム編集と体内ゲノム編集の2つの方法が考えられています。体外ゲノム編集は、患者から取り出した細胞にゲノム編集を施した後に患者に投与する方法です。体内ゲノム編集はゲノム編集ツールを直接患者の体内に導入する方法です。対象となっているものは、遺伝性疾患に限らず、HIVやがんなどさまざまな疾患に広がっています。
<農畜水産業への応用>
農畜水産業においてもゲノム編集は利用されています。日本国内においてはGABA(血圧上昇抑制効果があるアミノ酸)高蓄積トマトや可食部を増大させたマダイ、成長速度が2倍近くなったトラフグなどが実用化されています。その他、毒素を低減させたジャガイモ、収穫期に雨が続くと発生する、穂についたまま種子が発芽してしまい品質を低下させる穂発芽を起こしにくくするコムギ、無花粉スギなどの研究も進められています。
ゲノム編集が抱える課題
さまざまな分野への応用が進められ、今後も発展が期待されているゲノム編集ですが、生物に対して大きな影響力を持ちうる技術であり、まだ新しい技術でもあるため、いくつかの課題を抱えています。ここではゲノム編集の技術的課題、ヒトへの応用に関する倫理的課題、そして商用利用における権利の問題について紹介します。
<ゲノム編集の技術的課題>
ゲノム編集の技術的課題として、CRISPR-Cas9における「オフターゲット効果」と呼ばれる現象が知られています。これはターゲットとして狙っていたDNA配列とよく似たDNA配列を切断してゲノム編集が起きてしまう現象です。当初は特異性が高いシステムであると考えられていたCRISPR-Cas9ですが、次第に塩基配列認識にある程度の相違を許容する性質があることが明らかになってきました。医療応用においては、疾患と関係のないDNA配列や遺伝子を操作してしまうことは大きな課題で、オフターゲット効果により細胞ががん化してしまうことなどが心配されています。このオフターゲット効果を防ぐための技術開発が進められています。
<ヒトへの応用に関する倫理的課題>
ヒトの細胞、特に次世代まで遺伝子改変が引き継がれることになる生殖細胞に対するゲノム編集について慎重な議論が行われています。
2019年にはWHO(世界保健機関)に専門の委員会が設置されました。日本では、科学者の代表機関である日本学術会議から2020年にゲノム編集のヒトへの応用に関して提言が出されています。その提言の中には、ヒトの生殖へのゲノム編集の使用の法的禁止、ヒトの生殖への臨床応用を目指す基礎研究についても禁止、という内容が盛り込まれています。2023年にロンドンで開催された第3回ヒトゲノム編集に関する国際サミットでも、「ヒトの生殖に使用される胚または配偶子を対象とした遺伝性のヒトゲノム編集は、現時点では使用されるべきではない」という見解が出されています。
<ゲノム編集の商用利用における権利の問題>
研究分野において幅広い利用が進んでいるゲノム編集ですが、この技術を商業的に利用する際には開発者に対してライセンス使用料を支払う必要があります。現在ゲノム編集についての知財やライセンスの多くは米国が主導権を握っていますが、最も利用されているCRISPR-Cas9については米国内でも特許論争が生じています。このような背景から、日本国内でも独自のゲノム編集ツールの開発が進められています。
まとめ
ゲノムの特定のDNA配列を編集することができるゲノム編集は、基礎研究の進歩を加速させ、医療や農業などの分野においてもさまざまな可能性を持つ技術です。倫理面で考慮すべき点が多くありますが、今後、生物に関連する研究に取り組む人にとっては欠かせない技術の1つと言えるでしょう。更に研究が進み、安全で効率的な編集技術へと進化していくことでしょう。
記事執筆:吉田拓実(東京大学大学院農学生命科学研究科博士課程修了 博士(農学)/ 再考編集室 編集記者 / さいこうファーム 農場長)
(上記すべて参照:2025-3-6)