化学実験、バイオ実験のノウハウなど、毎日の実験・分析に役立つ情報をお届け。

日本最大の化学ポータルサイト「Chem-Station」さんとのコラボレーション記事。第7回目の今回は「第一手はこれだ!:古典的反応から最新反応まで2」について。著者はChem-Station代表のwebmasterさんです。
後半戦である第6回から3回に渡り「第一手はこれだ!:古典的反応から最新反応まで」と題して、実践的に使える合成反応の実験条件の選択についてお話しようと思います。前回は、酸化反応についてのみ取り上げました。今回は有機合成でよくつかわれる保護基と縮合反応ついて述べたいと思います。
保護基の選択:どれをなにでどんな条件で保護するか?
保護基は名前のとおり「反応したくない部分を守ってくれる」置換基です。分子を擬人化して話すと、「いろいろな攻撃から守ってあげたい分子くんがいるとして、どこに防具をつけてあげるか、どんな防具をつけてあげるか、どんな風につけてあげるか」ということですね。
と、基本的なところから話しているのと本題に入れなくなってしまうので、「保護基って何?おいしいの?」という方は、過去記事を御覧ください(過去記事:保護基のお話) 。
どの部分に防具をつけてあげるか、どんな防具をつけてあげるかに関してもたくさん種類があるのですが、今回は反応条件の第1手選択に関して、すなわち「防具をどんな風につけてあげるか?」にできるかぎり話を絞って説明しましょう。ついでに、「保護基は導入するより外すほうが大変!」とよくいわれるため、防具の外し方(脱保護方法)に関しても反応の選び方を説明します。
シリル系保護基の付け方・外し方
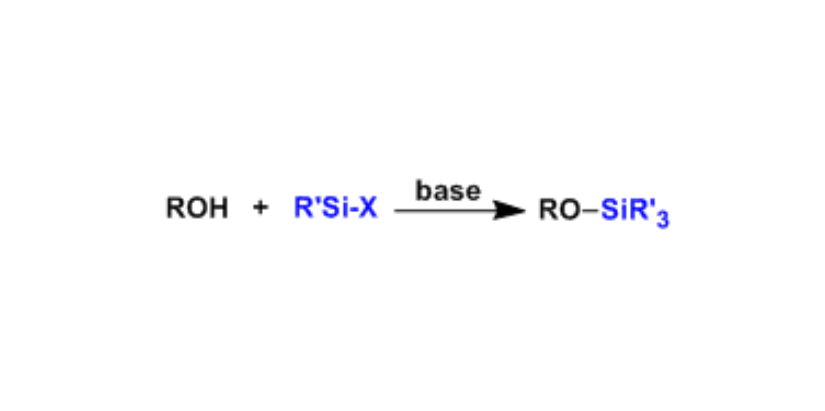
アルコールの保護基として不動の人気を誇るのがシリル系保護基です。「Chem-Station」でも毎年アクセスが高い記事の1つです。理由は単純で、「簡単につけれて外せるから」。
シリル基の嵩高さにより様々な種類が知られていますが、最もよく使われるのは、TBS基ですね。そして、反応条件の第一手は、TBSCl, imidazole, DMF条件です。最も安く、固体でコロっと投入可能で、比較的どんなアルコールでも保護することができます。DMF溶媒を使いたくない、ちょっと弱い条件でもよい(他に嵩高いアルコールがあるなど)の際は、TBSCl, NEt3 (DMAP), CH2Cl2条件をお使いください。逆に、ちょっとこの条件だと保護するのに時間がかかる、保護できない場合は、TBSOTf, 2,6-lutidine, CH2Cl2条件を選択しましょう。TBSOTfはTBSClに加えて高価ですが、アルコールとの反応性がより高いため、嵩高いアルコールでも保護することが可能です。具体的には、t-BuOHなどの三級アルコールを保護する場合に、TBSCl, imidazole, DMFでは3日かけても保護帯の収率は半分も達しませんが、TBSOTf, 2,6-lutidine, CH2Cl2条件ならば、10分でほぼ完結し定量的に保護体が得られます。これらの条件はTBSのみならず、すべてのシリル系保護基に共通するので覚えておきましょう。
一方で、シリル系保護基の外し方ですが、第1手はTBAF, THFもしくはHCl (or AcOH), THF/H2Oです。化合物が酸性に弱いか、塩基性に弱いか(強いか)で第一手が変わります。酸性に強い場合は、塩酸を作用させて外すのが、最も安価で楽です。反応が進行しない場合はぐつぐつ煮込んであげましょう。
酸性に弱い場合は、TBAF, THFを使いましょう。ケイ素とフッ素の親和性というシリル系保護基に特徴的な性質を使った優れた除去方法です。外れた際に、アルコキシドを生じるので、塩基性に弱い場合はそのアルコキシドの塩基性で化合物の分解が起こります。そういう場合は、酢酸(AcOH)を1当量添加したりすると、系内で生じたアルコキシドがすぐにプロトン化されることにより、塩基性による化合物の分解を防げることもあります。
温和なシリル系保護基の導入・除去法
ここまでが基本的な条件。金には糸目もつけないもしくはもうちょっと深くまでという人は少しだけ、マニアックな条件を。個人的にはトリアルキルシリルアセトニトリル(R3Si–CN)が結構好きです。なぜならこれを混ぜるだけでよいから。溶媒すらいらず。とくにTMS基の場合はTMSCNになると思いますが、アルコールにこれを適当にいれて混ぜてあとは余分なTMSCNを減圧留去するだけ。ただし、HCNが発生するのと、比較的反応性が高いケトンなどがあると、シリルシアノ化反応がいってしまうので注意。
また、反応条件が強く、中性に近い条件ですと、関西学院大学の田辺らが開発したSi-BEZAもおすすめです。TMS、TES基などTBS基よりも弱い保護基に限りますが、中性条件を突き詰めたいのならば、4-トリアルキルシロキシ-3-ペンテン-2-オンが個人的にはベスト。アルコールの反応性が低いとかかりませんが、混ぜるだけで完全中性条件です。
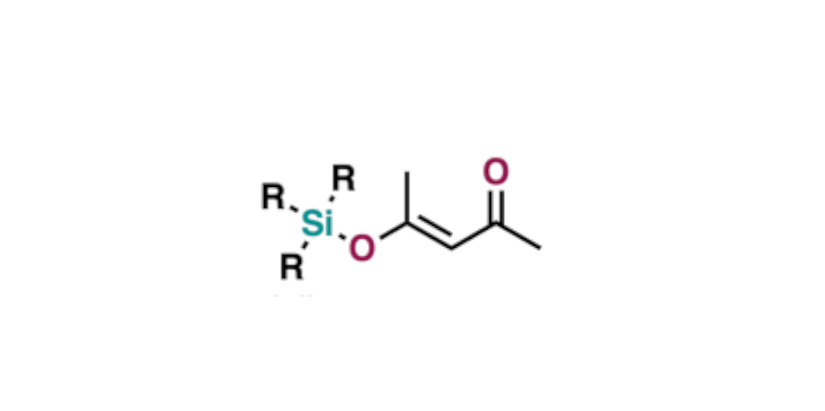
4-トリアルキルシロキシ-3-ペンテン-2-オン
外し方においては、1級のTBS基もしくは、TES基ぐらいならば、LiBF4, wet CH3CNもおすすめです。LiBF4は安価で固体なのでサラサラ加えることができる、DMF使わないくせにCH3CN溶媒なので結構極性の高い化合物も溶かすことができるからです。あまり使われていませんが、個人的には過剰なNH4F、MeOH条件も好きです。HF・Pyridineなどは中性に近い脱保護条件ですが、大量スケールでは見た目や後処理が困ります。NH4Fは安価で安定な塩ですしたくさん入れても問題有りません。シリケート塩であるTASFを使った方法も一時期流行りましたが、最近みない気がします。あまりにも高価すぎるからでしょうか。
あとは、シリル系保護基の選択方法にひとこと。基本的にはすぐはずす予定がなければ、容赦なく強い保護基(TIPS基やTBDPS基)を入れておいたほうがよいです。TBS基は結構はずれやすいですし、はずし分けなどのときに少し面倒なことになります。これも経験談ですが、学生時にTBDPSClが高いからだめだと言われて、結局1級アルコールの保護基にTBS基を選択し、2級アルコールに保護されたTES基とのはずし分けがきれいに進行せず、スタートへ戻りました。
抑えに抑えたのですが、シリル系のみで話が終わってしまうぐらいたくさん書いてしまいました。そのたよく使われるベンジル系やアシル系、さらに窒素を保護する、カルバメート系保護基などは過去記事(リンク参照)にも基本的な条件が載っていますので御覧ください。
水を出す縮合反応の第一手:まずは超基本的な条件から試してみよう
さて、話はかわり、今度は縮合反応の第一手です。縮合反応とは狭義にカルボン酸に一般的にアルコールやアミンなどを反応させて、エステルやアミドなどを作る反応です。理想的には水を生成する反応ですが、その「水」を効率よくそして、温和な条件で除くために様々な縮合反応や縮合剤が開発されています。
第一手は「いかに化合物が酸や塩基に安定であるか」によります。
例えば簡単な構造をもつカルボン酸とアルコールならば、圧倒的にコストが安いのは、教科書に載っている酸触媒(HCl)/トルエン溶媒でグツグツ煮てあげて、水をDean-Starkなどのガラス器具で水を除去してあげるのがベストです。カルボン酸のみが安定な場合は、塩化チオニルもしくはオキサリルクロリドにより酸クロリドに変えて、第三級アミンを加えたアシル化反応が最も安価かつ、反応性が高い手法です。もちろん高価な縮合剤を使っても悪いことはないですが、まずはこれでできないか試してください。
カルボン酸がそこそこ不安定であるならば、混合酸無水物法やトリクロロケトンに変換して反応させる手法もあります。それでもできない場合は、縮合剤の登場になります。
不安定な化合物の縮合反応
「不安定な」と書きましたが、酸や塩基をいれるだけで、壊れてしまうというのも不安定な化合物です。一方で、縮合反応の活躍場所は、かなりの割合でアミド結合のメッカである「アミノ酸の縮合」にあります。アミノ酸の場合縮合の場合不安定というのは、不斉点がラセミ化してしまうことも含まれます。基本的には活性化しすぎてラセミ化してしまう、途中の中間体がラセミ化する機構をとるという場合がほとんどです。
さて、ラセミ化を気にせず、そこそこ不安定な化合物を縮合させたいというのならば、やはり第一手は、EDC(WSC)。大学生でも教わるDCCでもよいですが、試薬はよく石のように固まっているのでゴリゴリするのも面倒ですし(やったことがあるひとなら意味がわかるはず)、副生するジシクロヘキシル尿素の除去も面倒です。EDCならば分液操作により、試薬や副生成物は水相へいってくれるため、そのような懸念点はなくなります。ラセミ化が懸念される際にはHOBtやHOAtなどを当量添加するのもコツです。いわゆる「仲人さん的」な役割をしてくれて、仲人さんが二人(カルボン酸とアミン)の状態を悪化せず縮合反応を進行させてくれます。
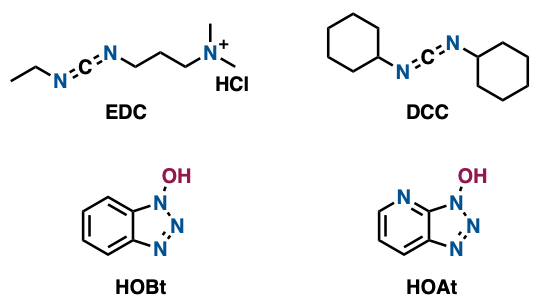
「こいつ水やアルコールにしか溶けてくれないんだけど!」という場合は、DMT-MMがよいですね。水やメタノールなどの溶媒中でも良好にアミド化反応が進んでくれます。
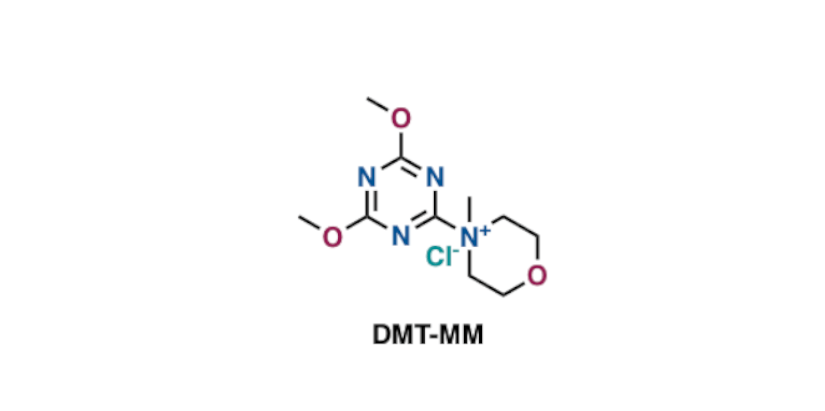
長くなりすぎたので塩基に弱い場合の話はほぼ割愛します。
高性能縮合剤を使った効率を求めた縮合反応
どんなにお金をかけても化合物のほうが貴重さ!というひとは、ぜひ最新の高性能縮合剤を使ってください。一番のおすすめはHATUです。大抵の縮合反応はこの縮合剤を用いると進んでくれます。HOAtをその構造に組み込んでいるてのため、ラセミ化の心配も解消されることが多いです。一方で、かさ高く非常に反応性が悪いカルボン酸とアミンなどではBOP-Clという反応剤が活躍していましたが、現在は発がん性の懸念があり発売中止になってしまいました。最近反応させるのが難しいアミド化をやっていないので、マニアックな条件などはわかりません。
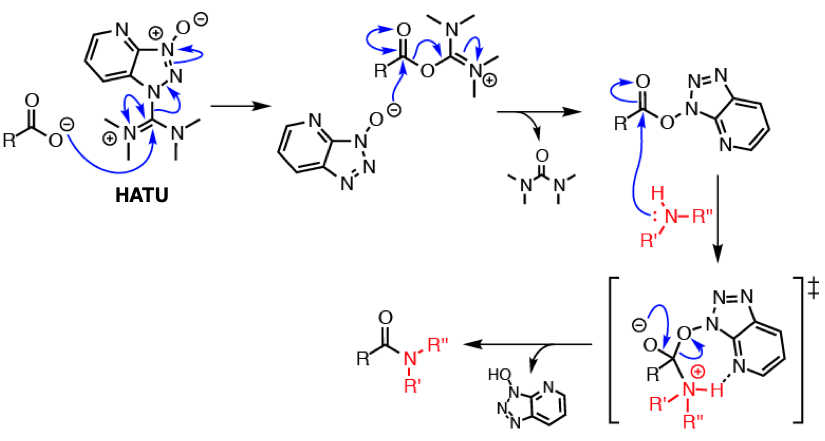
HATUを使った縮合反応(出典:Wikipedia[HATU]を改変)
*高価であるということを強調しているようですが、HATUも25gで2.3万円~3万円程度で購入できます。EDCは2万円前後なので、あまり変わらないかもしれません。とくにHOBtやHOAtを添加することを考えると高性能縮合剤の方がお得感あります。ただどちらにしても古典的な手法に比べると高価ですね。
たくさん使いそうな2つの反応を紹介しました
本当はいろいろな合成法の第一手を語りたいところではありますが、残念ながら本シリーズ(第一手はこれだ!:古典的反応から最新反応まで)は3回しか予定していないため、あと1回しか残されていません。次回は、クロスカップリング反応の第一手についてお話したいと思います。
関連記事Recommend
-

ものづくりのコツ:第10回「有機合成実験テクニック」
Chem-Stationコラボレーションシリーズ
-

実験を加速する最新機器たち|第9回「有機合成実験テクニック」
Chem-Stationコラボレーションシリーズ
-

第一手はこれだ!:古典的反応から最新反応まで3 |第8回「有機合成実験テクニック」
Chem-Stationコラボレーションシリーズ
-

第一手はこれだ!:古典的反応から最新反応まで|「有機合成実験テクニック」第6回
Chem-Stationコラボレーションシリーズ
-

もう別れよう:「化合物の分離・精製方法」第5回
Chem-Stationコラボレーションシリーズ
-

お前はもう死んでいる:不安定な試薬たち|「有機合成実験テクニック」第4回
Chem-Stationコラボレーションシリーズ
-

使っては・合成してはイケナイ化合物│「有機合成実験テクニック」第3回
Chem-Stationコラボレーションシリーズ
-

実験でよくある失敗集30選│「有機合成実験テクニック」第2回
Chem-Stationコラボレーションシリーズ
-

有機合成に活躍する器具5選│「有機合成実験テクニック」第1回
Chem-Stationコラボレーションシリーズ



