化学実験、バイオ実験のノウハウなど、毎日の実験・分析に役立つ情報をお届け。

タンパク質は生命機能を担う生体分子である一方、温度やpHの変化に対して感受性が高く、不安定な化学的性質をもちます。一方で、培養細胞からウェスタンブロットの試料を調製する際には、細胞を溶解する直前のタンパク質分子の状態を、可能な限り維持することが求められます。これを実現するための要点とプロトコールの例を以下にご紹介します。
(1)培養細胞からタンパク質を溶出する
抽出の際に使用する溶出バッファーには様々な選択肢があり、抽出する目的タンパク質のどのような性質を解析するかによって最適化されています。今回は、細胞内タンパク質を対象として、抗体抗原反応を用いたタンパク質の発現確認を主目的とする実験のプロトコール例をご紹介します。
このプロトコールでは、比較的穏和な条件でタンパク質を可溶化抽出することができるため、細胞内のタンパク質複合体を破壊せずにそのまま抽出することもできます。
試薬・器具の準備
- 培養細胞(HEK293T細胞など, 培養密度80%, 35 mm培養ディッシュ)
- 氷冷した溶出バッファー(50 mM Tris-HCl (pH 7.5), 150 mM NaCl, 1% NP-40, 10% グリセロール, プロテアーゼ阻害剤)
- 氷冷したリン酸緩衝生理食塩水(PBS)
- セルスクレーパー
- 1.5 mL マイクロチューブ
- ピペットマン・マイクロチップ
- ボルテックスミキサー
- 微量高速遠心分離機(低温設定)
実験プロトコール
- 細胞培養ディッシュ中の培地を吸引廃棄する。
- 2 mLの氷冷PBSをディッシュに添加して、細胞を穏やかに洗浄し、PBSを吸引廃棄する。
- 250-500 μL程度の氷冷溶出バッファーを細胞に添加し、全細胞に行き渡らせる。
- 氷上または低温室で15分間インキュベーションする。
- セルスクレーパーで細胞および溶出液をディッシュの一端にかき集め、ピペットマンを用いてマイクロチューブ内に回収する。
- ボルテックスミキサーを用いて、細胞溶出液を1-2秒間攪拌する。
- 穏やかに倒立攪拌を行い、細胞を溶解する(4℃, 15分間)。
- 遠心分離(15,000 rpm, 4℃, 10分間)を行う。
- 得られた上清を、可溶化タンパク質を含む細胞溶出液(セルライセート)として、新しいマイクロチューブに回収する。
- 必要に応じて、ライセート中のタンパク質濃度を測定する。
目的タンパク質の精製物が入手できるなど解析条件が揃えば、分子の存在だけでなく、発現量の同定や翻訳後修飾の有無も検出できます。
(2)SDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)によるタンパク質の分離
細胞溶出液(セルライセート)には無数のタンパク質が含まれます。SDSで変性させたタンパク質をポリアクリルアミドゲル中で電気泳動すると、原則として分子量が小さいタンパク質ほど速く泳動されるため、多種類のタンパク質分子を分子量の差異をもとに仕分けることができます。よって、分子量が既知のタンパク質(分子量マーカー)を試料と並行して泳動すると、泳動度の比較から試料中のタンパク質の分子量を推定することができます。
SDS-PAGEの試料は、タンパク質を含む細胞溶出液にSDS(陰イオン性の界面活性剤)と還元剤(2-メルカプトエタノールまたはDTTなど)を加えることで調製します。これにより、タンパク質の2次構造・3次構造・4次構造が変性するため、いずれのタンパク質も同等に負電荷を帯び、タンパク質が本来もっていた立体構造や性質にかかわらず、電場の中で分子量の小さな順にタンパク質を分離できます。タンパク質の泳動速度はゲル中のアクリルアミド濃度にも依存し、高濃度のゲルほど網目が細かく、より低分子量タンパク質の分離に適したゲルとなります。以下にSDS-PAGEのプロトコールの一例をご紹介します。
試薬・器具の準備
- 4 x SDSサンプルバッファー(250 mM Tris-HCl (pH 6.8), 20% 2-メルカプトエタノール, 8% SDS, 20% ショ糖, 0.008% ブロモフェノールブルー)
- 分子量マーカー
- ミニゲル用電気泳動装置一式(泳動槽、コーム、クリップ、電源装置)
- アクリルアミドゲル(SDS-PAGE用プレキャストゲル, ミニサイズ(10 cm x 10 cm, 1.0 mm厚))
- 電気泳動バッファー(25 mM Tris, 192 mMグリシン、0.1% SDS)
- マイクロピペット、ゲルローディングチップ
実験プロトコール
Ⅰ. SDS-PAGEサンプルの調製
- マイクロチューブ内で、適当量の目的タンパク質を含む細胞溶出液と4 x SDSサンプルバッファーを体積比3 : 1で混和し、「SDS-PAGEサンプル」を調製する。
- 溶出バッファーと4 x SDSサンプルバッファーを、体積比3 : 1で混和した1 x SDSサンプルバッファーを調製する(空レーン用)。
- SDS-PAGEサンプルを加熱処理する(95℃, 5分間)。内圧が上昇してサンプルが漏出しないように注意する。
- SDS-PAGEサンプルを室温で冷却する。チューブ内壁についた水滴を遠心操作でチューブ底部に回収し、サンプルと混和する。
Ⅱ. 電気泳動装置・ゲルの組み立て
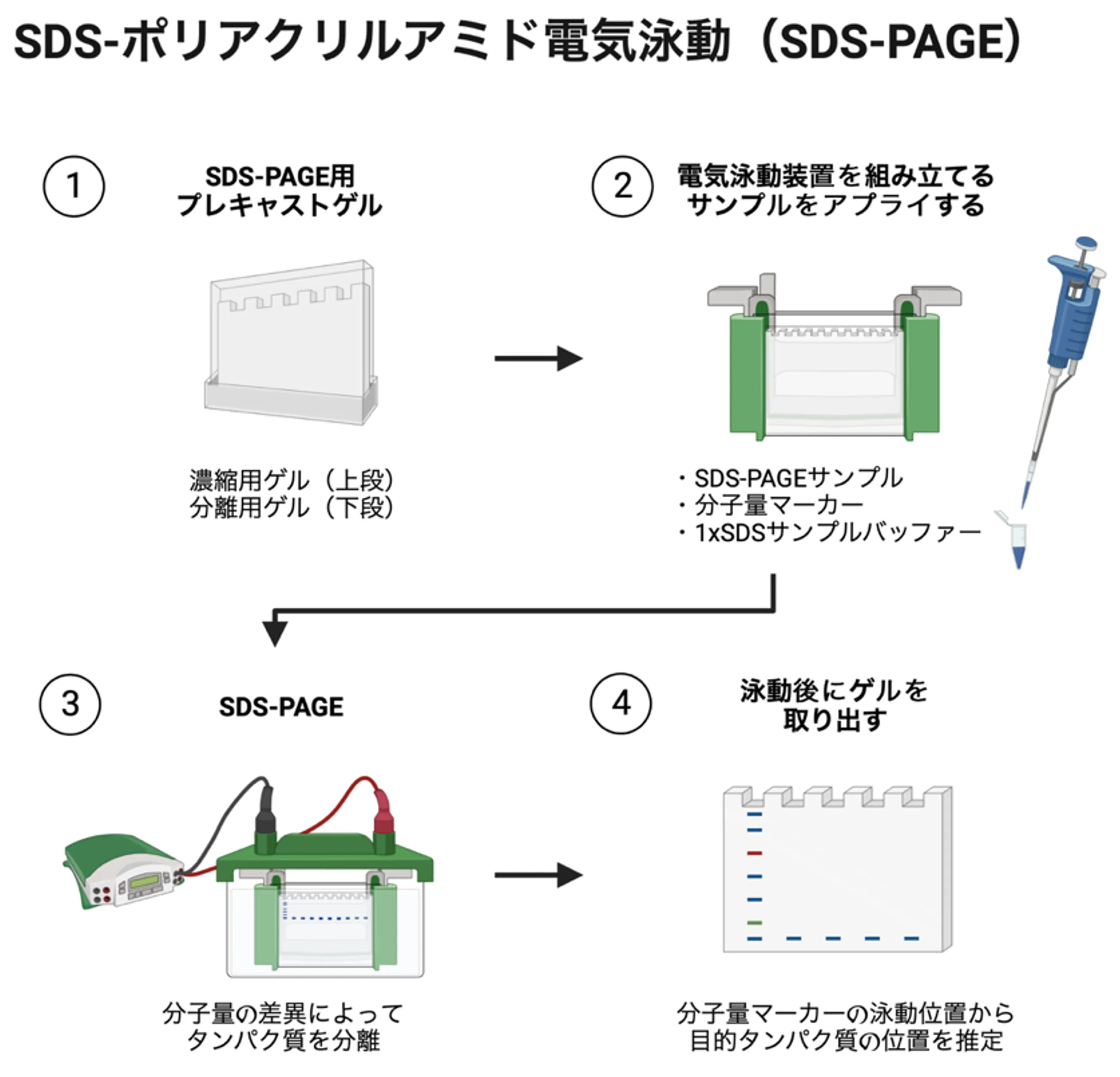
- 適切なアクリルアミド濃度の分離用ゲルに、濃縮用ゲルが重層されたSDS-PAGE用プレキャストゲルを、電源装置に接続された電気泳動装置に設置する[下図 ①]。
- 電気泳動装置の陽極槽と陰極槽に適量の電気泳動バッファーを満たす。
- 濃縮用ゲルからコームを慎重に引き抜き、ウェル内を泳動バッファーで穏やかに流水洗浄する。
- 上記で調製したSDS-PAGEサンプル、分子量マーカー、1 x SDSサンプルバッファー(空レーン用)をウェル内にそれぞれ穏やかにアプライする(10-20 μL/ウェル程度)[下図 ②]。
- 一定電流(20 mA/ゲル)の条件で電気泳動を開始する[下図 ③]。ブロモフェノールブルーや分子量マーカーの泳動度をもとに、適当な時点で泳動を止める。
- 電気泳動装置からゲル板を取り外す[下図 ④]。
- ゲル板から取り外したゲルをウェスタンブロットの転写バッファーに浸す(以降、ウェスタンブロットに続く)。
*監修
パーソルテンプスタッフ株式会社
研究開発事業本部(Chall-edge/チャレッジ)
研修講師(理学博士)
この記事は、理系研究職の方のキャリア支援を行うパーソルテンプスタッフ研究開発事業本部(Chall-edge/チャレッジ)がお届けする、実験ノウハウシリーズです。
過去の記事一覧:実験レシピシリーズ
関連記事Recommend
-

進化する生命科学の探究者、真下教授の「人生を変えた私の5冊」
博士の本棚(第11回)│東京大学 真下知士さん
-

フローサイトメトリー(2/2) プロトコル編
リケラボ実験レシピシリーズ
-

尿からmiRNAを捕捉し、ステージ1からがんを早期発見。技術顧問としてのベンチャー共同創業
Craif株式会社 共同創業者・技術顧問 安井隆雄
-

話題作『研究者、生活を語る』—担当編集者に聞く「『両立』の舞台裏」に込められた想い
-

フローサイトメトリー(1/2)概要と原理編
リケラボ実験レシピシリーズ
-

独自のバイオインフォマティクス技術で、世界を変える酵素をデザインする
株式会社digzyme 代表取締役CEO 渡来 直生
-

<20代理系社会人の方へ>仕事・転職に関するアンケートにご協力お願いします!
リケラボ×20代の働き方研究所 協働プロジェクト
-

淡水魚と海水魚が一緒に生息できる「魔法の水」とは?世界の食料問題に立ち向かう「好適環境水」による陸上養殖
-

スキンケアの疲労回復効果を検証!日常に取り入れる「疲労の科学」
~大阪公立大学健康科学イノベーションセンター~
-

「子どもたちを心臓の再手術から救いたい」――。思いを叶えるために根本教授が採ったユーザーイノベーション戦略
心・血管修復パッチ「シンフォリウム®」開発のキーマンに聞く「医師にしかできないサイエンス」とは