科学者・研究者・研究開発者の職種紹介や転職情報など、理系キャリアに関する情報をお届け。
就職・転職活動を行う上で欠かせない業界研究。リケラボでは理系の方が活躍する各業界の情報をお届けしています。今回は再生医療業界の「基礎知識」編です。
そもそも、再生医療とは?

Q:最近、再生医療の話題をよく耳にしますが、そもそも再生医療とは何なのでしょうか?

A:再生医療とは、ひとことでいうならば、病気やケガで機能が失われた体の一部を特殊な細胞のチカラで再生させる医療のことです
■再生医療とは
病気やケガで体の機能が失われるということは、つまり細胞がなくなる(もしくは細胞に異常が起きて働かなくなる)ということです。再生医療では、体外で人工的に培養した細胞、あるいは人工的に構築した臓器などの組織を移植し、失われた機能の修復・再生をします。
人間には、軽いケガなどを自然治癒する能力は備わっていますが、著しく機能を失ってしまった部分を再生することは困難です。そのため、人工関節を開発して埋め込んだり、臓器を移植したりといった手法が取られてきました。しかし、拒絶反応、感染症、ドナー不足など、課題やリスクもあります。一方で、近年注目されている細胞を用いた再生医療は、体外で人工的に培養した細胞、あるいは人工的に構築した臓器などの組織を患者に移植し、臓器や組織など体の一部を再建する試みです。医療機器や他人の臓器といった異物を使わずに、細胞を用いて本来の健康な状態に戻すということは、つまり「根治療法」が可能になるということで、多大な期待が寄せられています。脊髄損傷やパーキンソン病など難病の治療法が新たに確立されたり、治療期間の短縮によって患者のQOL(Quality of Life:生活の質)を向上させることにも可能性が広がります。
再生医療の定義は幅広いのですが、リケラボでは厚生労働省の定義を使用します。
再生医療の定義
1、患者の体外で人工的に培養した幹細胞等を、患者の体内に移植等することで、損傷した臓器や組織を再生し、失われた人体機能を回復させる医療。
2、ないしは、患者の体外において幹細胞等から人工的に構築した組織を、患者の体内に移植等することで、損傷した臓器や組織を再生し、失われた人体機能を回復させる医療
(出所:厚生労働省・多能性幹細胞安全情報サイトより)
■再生医療のカギを握る“幹細胞”
私たちの体は、さまざまな役割をもつ約60兆個もの細胞が集まってできています。人間の細胞は大きく分けて「生殖細胞」と「体細胞」に分けられます。「生殖細胞」は精子と卵子になる細胞です。一方「体細胞」は、生殖細胞以外のすべての細胞を差し、皮膚、血液、神経、臓器、骨など、それぞれの場所で適切な働きができるよう、異なる機能を担っています。受精卵が分裂したばかりの頃の細胞は、まだ役割が定まっていませんが、「分化」を繰り返すことで、性質が変化し、それぞれの機能を持った「体細胞」になります。分化が完了した「体細胞」は、ほかの機能を持った細胞に分化することはありません。(細胞が様々な違う種類の細胞に変化する能力のことを「分化能」と呼び、多くの機能に分化できることを「多能性」と言います。)
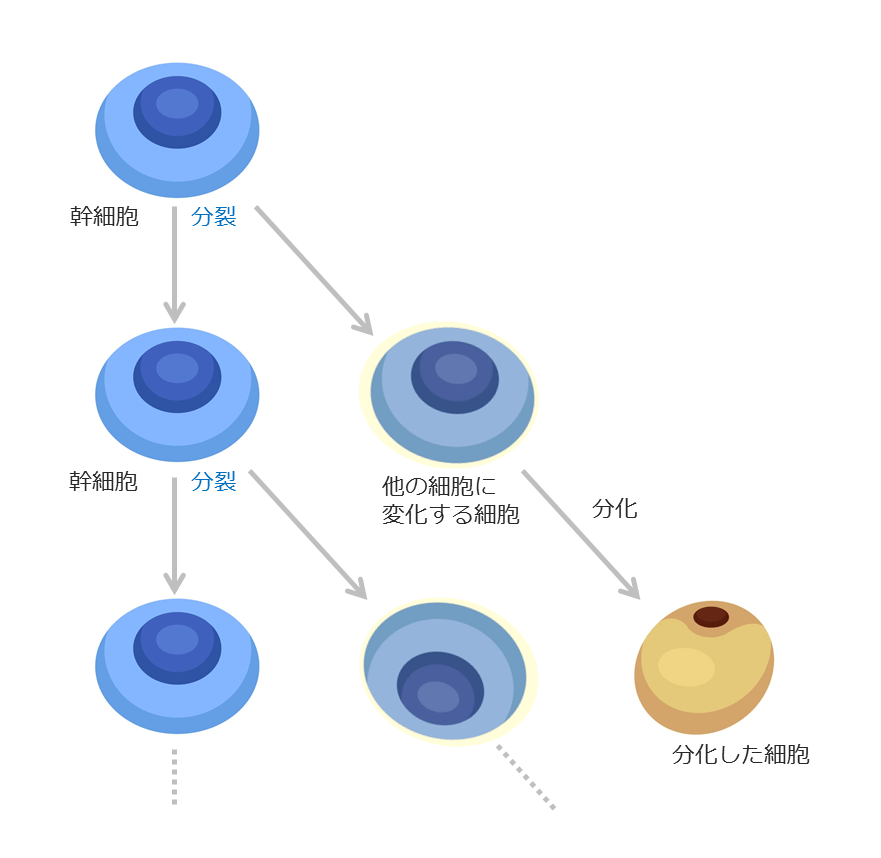
ところで、細胞には寿命があります。皮膚や血液などが分かりやすい例ですが、常に新しい細胞を作り補充しないと維持できません。そのため、人間の体内には、新しい細胞を生み出す役割を持つ細胞があります。これを「幹細胞」と呼びます。「幹細胞」は、傷ついたり古くなってしまった細胞を入れ替えるため、常に新たな細胞を作っています。幹細胞は分裂することで新しい細胞を生み出します。幹細胞が生み出した新しい細胞は、色々な細胞に変化(分化)することができます。体内のほとんどの細胞は、分裂の回数に限界があり、数十回分裂するとそれ以上分裂できなくなるのですが、幹細胞は無限に分裂することができます。
このように、幹細胞は、分化能を維持しながら無限に細胞分裂を繰り返し、新しい細胞を生み出す工場のような役割を果たしています。「分化能」と「自己複製能」の二つが幹細胞の大きな特色です。
再生医療では、主に幹細胞を培養して人工的に分化誘導することで、目的の細胞や組織を再生していくことを目指しています。
iPS細胞だけではない。再生医療に必要な幹細胞とは?

Q:再生医療といえば“iPS細胞”というイメージがあります。iPS細胞は、なぜ注目されているのですか?

A:iPS細胞は、どんな組織にも分化できる“万能細胞”で、なおかつ分化した体細胞から作製できるのが特徴です。京都大学の山中伸弥教授らによって開発されました。iPS細胞が注目される理由をお伝えするために、まずはほかの幹細胞についてもご説明しましょう
■再生医療に用いられる幹細胞
現在、再生医療に用いられている(または応用に向けて研究が進められている)幹細胞には、もともとヒトの体内に存在するものと、人工的に作られたものがあります。
体内にある幹細胞は採取できる数が少なく、また体外で増殖・維持させるのが難しいため、1990年代に人工的に幹細胞が作製できるようになったことは非常に画期的なことでした。
代表的な幹細胞を下記に紹介します。
<成体幹細胞(体性幹細胞・組織幹細胞)>
成体幹細胞は、体内に存在し、すでにある程度特定の機能に分化しています。いくつかの種類が見つかっており、例えば、造血幹細胞は血液中にある赤血球や血小板などの血液細胞へ、上皮幹細胞は皮膚を構成する細胞へ、神経幹細胞は神経系の細胞へ、といった具合に特定の組織に向けてのみ分化します。例外的に「間葉系幹細胞」(骨髄や脂肪組織に存在)は、骨、軟骨、血管など比較的幅広い組織に分化することができます。これらはヒトの体内にある細胞をほぼそのまま使用できるため、他の人工的な幹細胞に比べて低リスクです。そのため、再生医療に用いられる幹細胞のなかではもっとも臨床への応用が進んでおり、実際に白血病の治療などに使われています。ちなみに、胎児の血液に含まれている幹細胞は臍帯血幹細胞と呼ばれ、出産後のへその緒からしか採取できないため希少ですが、造血幹細胞と間葉系幹細胞を含んでいます。
<ES細胞(胚性幹細胞)>
ES細胞は、生体幹細胞と違ってあらゆる細胞に分化することができるため、多能性幹細胞とも呼ばれます。1998年にアメリカ・ウィスコンシン大学のトムソン氏によって樹立されました。ES細胞のもとになるのは、胚のなかから取り出した幹細胞で、これを培養して作ります。胚とは、受精卵が分裂して胎児になるまでの段階のものです。つまり、ES細胞は胎児になる可能性を持った細胞から作ることになります。不妊治療などで生じた余剰胚を用いるとはいえ倫理上の懸念も多く、日本では厳しく規制されていますが、世界的にみるとES細胞の研究は盛んに行われており、海外では治験も実施されています。
<iPS細胞(人工多能性幹細胞)>
iPS細胞は、京都大学の山中伸弥教授らが開発した“多能性幹細胞”です。すでに分化した体細胞に、4種類の遺伝子(通称:山中ファクター)を導入し培養することで、人工的に未分化の状態に戻します(=リプログラミング)。「人工多能性幹細胞」の英語表記「induced pluripotent stem cell」から頭文字をとって、「iPS細胞」と名付けられました。多能性はES細胞と同質といわれ、なおかつ倫理的な問題も払拭できたため世界的に注目を集めました。そして2012年、iPS細胞の開発の功績により山中教授がノーベル医学生理学賞を受賞したことは、日本において再生医療への注目度を一気に高めるきっかけとなりました。
ES細胞もiPS細胞も拒絶反応の問題や、作製・分化のプロセスでがん化しやすいなどの課題がありましたが、その後の研究の成果で徐々に克服されつつあります。
基礎研究の実験で様々な検証が終わったものは、そのあと臨床の現場で少数の患者さんの協力のもと、何年もかけて安全性や副作用を慎重に確認していくのですが(このプロセスを臨床研究という)、ようやく日本でもこの段階に到達するテーマが増えてきています。
| ES細胞 | 成体幹細胞 | iPS細胞 | |
|---|---|---|---|
| 由来は? | 胚から作られる | からだの中に存在する | 体細胞から作られる |
| 多能性はあるか? | ○ | × | ○ |
| 胚や卵子の滅失に関わる倫理的問題は避けられるのか? | × | ○ | ○ |
| 移植の際の適合性は?* | △ | ○ | ○ |
| 医療応用上の主な課題は? | ヒトでの安全性確認が重要 | 体外で増殖・維持するのが難しい | ヒトでの安全性確認が重要 |
*移植の適合性は免疫の型(HLA)が一致するかどうかで決まり、一致しない場合には拒絶反応がおきます。ES細胞は患者さん本人の細胞から作成することはできませんが、免疫の型が一致する細胞を利用する場合は拒絶反応を避けることが可能です。
図表出典:(独)科学技術振興機構(JST) 再生医療研究推進部『幹細胞ハンドブック からだの再生を担う細胞たち』第10版/2014 年 12 月 8 日発行(P.7より引用)
急速な発展を遂げる再生医療

Q:再生医療研究は今どのような状況なのでしょうか?

A:今まさに、さまざまな臨床試験が実施されようとしています。難病の治療法が確立するなど、実用化がどんどん進んでいくことが期待されています。
■再生医療研究のあゆみ
| 1970年代 | ヒト表皮細胞の培養技術の確立(Greenら) |
| 1993年 | ティッシュエンジニアリング(生きた細胞を用いて組織や臓器を人工的に作り出す技術)の提唱(Langer, Vacantiら) |
| 1998年 | 米国でヒトES細胞(胚性幹細胞)の樹立(J.Thomson) |
| 2003年 | 日本でヒトES細胞(胚性幹細胞)の樹立(中辻憲夫) |
| 2007年 | 日米でヒトiPS細胞の樹立発表(山中伸弥, J.Thomson) |
| 2010年 | 米国で脊髄損傷患者にヒトES細胞を用いる世界初の臨床試験を開始 |
| 2012年 | 山中伸弥教授 ノーベル生理学・医学賞受賞 米国でヒトES細胞を用いた臨床試験(視力回復)に成功 |
| 2014年 | 日本で滲出型加齢黄斑変性の患者にiPS細胞を用いる世界初の臨床試験開始 |
| 2015年 | 京都大学がパーキンソン病にiPS細胞を使う治療の手続きを開始 |
| 2017年 | 理化学研究所などが患者本人以外のiPS細胞を使った移植手術を実施 京都大学がiPS細胞を活用して発見した薬の世界初の臨床試験が開始 |
■再生医療研究の現在地
細胞を使用した再生医療(細胞治療)は造血性幹細胞を患者に注入する白血病の治療から始まりました。
1970年代から細胞培養の技術が発達し、生きた細胞からシート状の組織を構築して人体に適応する技術が開発され始めました。
特に1993年以降、MITのLangerとハーバードのVacantiらが、生命科学と工学の融合ともいえるこの技術分野をティッシュエンジニアリングと名付けます。
1998年にウィスコンシン大学でJamesThomsonがES細胞を樹立すると、幹細胞を用いた再生医療の研究が世界中で加速します。
すでに述べたとおり、ES細胞は倫理面の問題が残るため日本ではあまり研究が進まず、2007年に山中教授がiPS細胞を確立しました。
2014年にはiPS細胞から作製した網膜組織の細胞を移植する世界初の臨床研究が実施され、話題を集めました。この臨床研究では、滲出型加齢黄斑変性の患者に自己iPS細胞由来網膜色素上皮細胞シートが移植されています。
iPS細胞樹立から10年余り。
現在脊髄損傷やパーキンソン病、重症心不全、血液などの領域でiPS細胞を使った臨床研究や治験が計画されており、国からの承認が下りれば開始される見通しです。また、ES細胞に関しても、国内初の治験が年内に始まります。(2018年5月21日現在)
iPS細胞やES細胞を使った再生医療の安全性が確立され、広く医療として普及するまでにはあと20年はかかると言われていますが、臨床応用への研究が本格化したのは大きな進展だと言えるでしょう。
その他にも、体細胞や成体幹細胞を用いた治験が実施されており、すでに承認されている再生医療等製品は4品目あります。
創薬研究でも再生医療研究で培われた細胞の技術が活用されています。
次回は、再生医療に関わる創薬研究や再生医療製品をとりまく市場動向についてご紹介していきます。
関連記事Recommend
-

理系の職種紹介vol.10 研究支援ソフトウェア/ソリューション営業の仕事
株式会社レビティジャパン -有機合成博士が強力に推進する研究DX-
-

理系の職種紹介vol.9 家電の生産技術の仕事
日立グローバルライフソリューションズ株式会社
-

理系の職種紹介vol.8 化学メーカーにおける素材開発の仕事
DIC株式会社
-

理系の職種紹介vol.7 食品メーカーにおける製品開発の仕事
日清食品グループ グローバルイノベーション研究センター
-

理系人材が活躍!貴重な文化財を守る「保存科学」とは?
国立民族学博物館・日髙教授の仕事に迫る。 -

科学の眼差しで描くイラストレーション
「サイエンスイラストレーター」の仕事拝見〜北海道大学CoSTEP 大内田美沙紀先生〜
-

理系の職種紹介vol.6 サイエンスコミュニケーターの仕事(資生堂編)
株式会社資生堂 ブランド価値開発研究所
-

アルコールがついても字が消えない!理化学系研究者の救世主、コクヨ“リサーチラボペン”開発担当者を直撃しました!
-

「卵アレルギーでも食べられる卵」を研究!卵研究とレシピ開発の強力タッグで、全ての人が安心して食べられる卵製品を届けたい
理系のキャリア図鑑vol.32 キユーピー株式会社 児玉大介さん、岩本知子さん
-

入社後の初仕事は研究所の立ち上げ!牛の尿の発酵液で環境課題を解決する 環境大善株式会社 加藤勇太さん
地方中小企業躍進の現場で活躍する理系人



