
エピジェネティクスとは
DNAの塩基配列に依存しない遺伝子の調節機構、またはそれを対象とする研究分野のことをエピジェネティクスといいます。エピジェネティクスという言葉は、「超」、「上」や「周辺」を意味する「エピ」という接頭語と、遺伝学を表す「ジェネティクス」を合わせて作られました。そして、エピジェネティックな変化とは遺伝子配列そのものを変化させることなく遺伝子のオン・オフを制御する、DNAなどにみられる化学的修飾のことです。
生物の体はタンパク質によって形作られています。タンパク質はアミノ酸が連なってできており、その配列は細胞の核にあるゲノムDNAの配列情報が元になっています。哺乳類の発生では、1つの受精卵から増殖・分化を繰り返して、最終的にさまざまな形態や機能を持つ細胞が約270種類できます。すべての細胞において基本的にゲノムDNAの配列は同一です。にもかかわらず、それぞれの細胞において機能や形態が異なるのはなぜでしょうか。それは、各場所やタイミングで、必要な遺伝子の発現がオンに、不必要な遺伝子の発現はオフにされているからです。エピジェネティック機構はDNAを構成している塩基配列を変えることはありませんが、遺伝子のオン・オフの制御を行うことで細胞内のタンパク質の合成に影響を与えています。
エピジェネティック機構の仕組み
エピジェネティックの制御機構として、ヒストン修飾やDNA修飾がよく知られています(詳細は以下で説明します)。近年ではこの2つにとどまらず、さまざまな規模・レベルでDNAの塩基配列に依存しない遺伝子発現のオン・オフに関わる分子機構が研究されていますが、本記事では、ヒストン修飾とDNAのメチル化について説明していきます。
<ヒストン修飾>
エピジェネティックの仕組みを理解するために、ゲノムDNAが普段どのように細胞の核に収納されているのかを知ることが重要です。ヒトゲノムの場合、約30億塩基対とされる膨大な量のDNAが核に収納されています。そのDNAのコンパクトな収納を実現するために使われているのがヒストンタンパク質です。
ヒストンタンパク質はH1、H2A、H2B、H3、H4の5種類があり、そのうちH1を除く4種類はコアヒストンと呼ばれ、それぞれ2つずつからなる8量体を形成しています。DNAの収納の1段回目はこの8量体のヒストンタンパク質に147塩基対のDNAが1.7回転巻き付くことで行われます。この構造はヌクレオソームと呼ばれます。さらにDNAの収納の2段階目としてこのヌクレオソームの繰り返し構造がらせん状に巻かれます。これがクロマチンと呼ばれます。ヒトのような真核生物のDNAが格納された染色体はこのクロマチン構造を取っています。
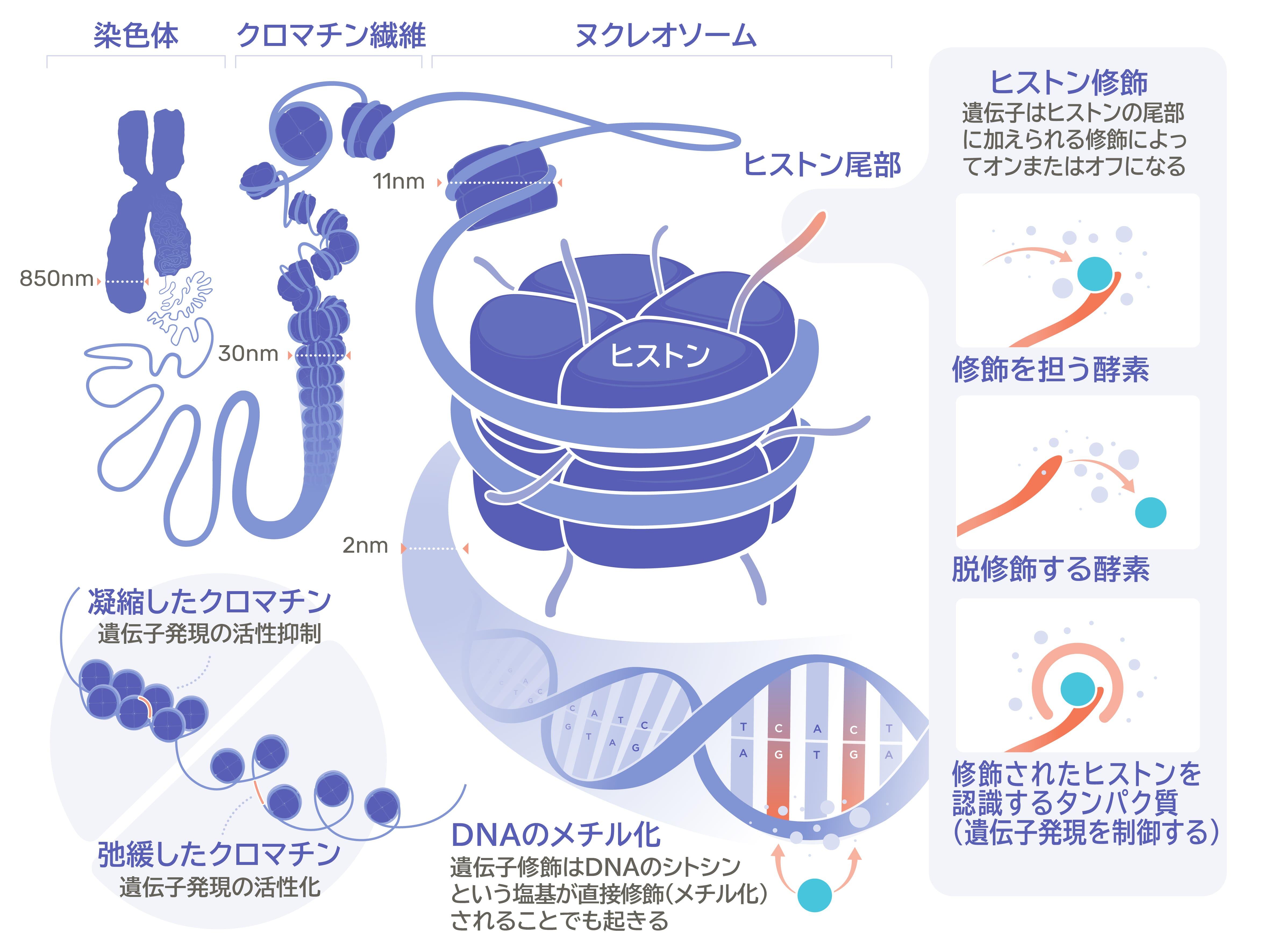
クロマチン構造を変化させるヒストン修飾の例としては、アセチル化、メチル化、リン酸化、ユビキチン化などが知られています。ヒストンが修飾を受けると、DNAを折りたたんでいるクロマチン構造が変化し、遺伝子発現が変化します。例えばヒストンのアセチル化では、クロマチン構造が緩む方向に変化します。クロマチン構造が緩んだ場所にあるDNAに遺伝子の発現を制御する転写因子などの核内因子が接近しやすくなり、その結果、遺伝子の発現が活性化されます。
また、これらの修飾を除去する反応も知られています。ヒストン脱アセチル化酵素は、ヒストンのアセチル化を除去することでクロマチン構造を引き締め、遺伝子発現を抑制します。
<DNAのメチル化>
もうひとつの代表的な修飾はDNAのメチル化です。
こちらは、DNAにメチル基と呼ばれる小さな化学基(1つの炭素原子と3つの水素原子で構成される)が結合することで、遺伝子の発現が制御されます。(たいていはオフもしくはサイレンシングとなる)
DNAはA(アデニン)、T(チミン)、G(グアニン)、C(シトシン)の4つの塩基の並びで構成されています。Cの次にGが続くCG配列のCにメチル基(-CH3)が付加され、5-メチルシトシンになることがDNAのメチル化です。哺乳類ではこのメチル化を起こす酵素が3種類、脱メチル化を起こす酵素が3種類見つかっています。DNA配列の中にはCG配列が多く存在する領域(CpGアイランド)があり、この領域のDNAのメチル化が遺伝子制御に深く関与することが分かっています。DNAのメチル化は転写因子が結合するのを妨げることや、転写抑制因子を引き寄せることで、多くの場合遺伝子発現を抑制するとされています。また、DNAのメチル化パターンは細胞分裂に伴うDNA複製後も受け継がれることが知られています。
エピジェネティックの異常が関連する疾患と創薬
エピジェネティックの異常が疾患の原因の1つとなることも分かってきました。このような疾患には2つのタイプがあります。本来遺伝子発現がオンになっている遺伝子が異常なDNA修飾のためオフになり疾患が発症するものと、本来遺伝子発現がオフになっている遺伝子が正常なDNA修飾が失われてオンになっているものです。
日本人の死因の第1位であるがんはエピジェネティックの異常が関連する疾患として知られています。がんの発症メカニズムとして、がん遺伝子やがん抑制遺伝子の異常が解析されていましたが、エピジェネティックの破綻も重要であることが分かってきました。がん化の初期イベントとして、ゲノム全体で遺伝子の発現活性化につながる低メチル化が進みます。一方で、特定の部位においては逆に遺伝子の発現抑制につながる高メチル化が認められます。高メチル化が起きているのはがん抑制遺伝子の発現を調節する領域で、これによりがん抑制遺伝子の発現が抑えられてしまいます。さらに、がん細胞においてはゲノム全体でヒストン修飾の異常も認められていて、これもがん化の初期に起こっている可能性が示唆されています。特にゲノム全体におけるヒストンアセチル化の消失は、多くのがんでヒストン脱アセチル化酵素の発現が増加していることからもよく知られた現象で、さまざまながん抑制遺伝子の発現や機能の抑制に関与すると推測されています。
エピジェネティックの異常はDNA配列の変化が起きないため、元に戻すことが可能だと考えられます。そのため、エピジェネティック異常を標的とした治療薬の開発が進められています。DNAメチル化に関わるDNAメチル基転移酵素を阻害する薬や、ヒストンアセチル化消失に関わるヒストン脱アセチル化酵素を阻害する作用の薬などが、エピジェネティクス制御を狙った薬としてアメリカ食品医薬品局(FDA)での承認を受け、その後日本でも承認されています。
エピジェネティック異常が起こす疾患についての研究は、がんで特に進んでいます。がん治療の際に手術で組織を切除することからサンプル入手が比較的容易なためです。一方で、他のさまざまな疾患とエピジェネティックによる制御の関与についての研究も行われています。例えば妊娠中の母体の栄養状態と胎児の将来的な肥満や糖尿病リスクとの関係(DOHaD説として次章で紹介します)、統合失調症などの精神神経疾患、アレルギーや自己免疫疾患、腎臓・心臓疾患などもエピジェネティクスとの関連が報告されています。疾患メカニズムの解明が進めば、より効果の高い薬や治療法(予防法)の開発につながります。そういった意味でもエピジェネティックス研究は、今後の進展が大いに期待されるところです。
エピジェネティックに影響を与える要因
エピジェネティックに影響を与える要因には先天的なものと環境要因による後天的なものがあります。また親の世代で受けたエピジェネティックの変化が子の世代へと引き継がれる場合があることも分かってきています。
<先天的なエピジェネティック>
エピジェネティックな変化が関わる疾患として最初に報告された小児性疾患は先天的なゲノム刷り込みに関係するものでした。
哺乳類は有性生殖によって両親から1セットずつゲノムを受け継ぎます。父方の遺伝子と母方の遺伝子のほとんどは、その子どもにおいて等しく発現しますが、一部の遺伝子はどちらかしか発現しません。これは双方の遺伝子のメチル化状態の差によって起こることが知られており、この現象がゲノム刷り込みと呼ばれます。
ゲノム刷り込みは、遺伝情報に恒久的変化を与えず、世代ごとに新たにプログラムされるエピジェネティックな現象です。
<後天的なエピジェネティック>
後天的なエピジェネティックの変化として知られている例として、女王蜂の誕生があります。
女王蜂はメスの働き蜂が幼虫時にローヤルゼリーを与えられることにより作られます。このローヤルゼリーには、DNAメチル化酵素の働きを抑制する効果があることが分かりました。実際にローヤルゼリーとは別の方法でDNAメチル化酵素の発現を抑制させると、女王蜂が誕生することも明らかになりました。
ヒトにおいても、後天的なエピジェネティックな変化(特に胎児期や乳児期といった発達初期における環境要因)が成長後の健康やさまざまな疾病発症リスクに影響を及ぼす原因の一つではないかとして研究が進められています。(DOHaD説:developmental origins of health and disease )。この学説を支持する例として、第2次世界大戦時にオランダ飢饉を経験した母親から生まれた子どもたちの研究がよく知られています。飢饉を経験した母親から生まれた群は、経験しなかった群と比較して、19歳の時点における肥満率が高いことが分かりました。さらに、同様の群に対して60歳の時点で比較したところ、飢饉を経験した母親から生まれた群は成長ホルモンとの関連が示唆されている遺伝子プロモーター領域のメチル化が低くなっていることが分かりました。成長ホルモンは、脂肪細胞において脂肪分解を促進し、それが体脂肪を減少させることに繋がっていると考えられています。これらのことからDOHaD説の原因の1つとしてDNAのメチル化が関わっていると示唆されるようになりました。
<親から子へと受け継がれるエピジェネティック>
2020年に理化学研究所によるセンチュウを使った実験では、親世代が獲得したストレス耐性がエピジェネティックな遺伝により子へと継承されるという報告がされました。
これまで、センチュウは酸化ストレスなどのストレス応答にヒストンのメチル化が関わっていることが知られていました。実験では親世代のセンチュウの特定の遺伝子を欠損させヒストンのメチル化を減少させるとストレス耐性が上昇することが確認されました。さらに、そのセンチュウの子世代のストレス耐性を調べると、向上したストレス耐性が引き継がれていることが分かりました。親世代で欠損していた遺伝子は子世代では正常であるにも関わらず、ストレス耐性が引き継がれていたことから、親世代のエピジェネティックの変化が子世代にも引き継がれていたことが示唆されました。
まとめ
生物学の発展により遺伝子としてのDNAの存在が明らかになり、ヒトゲノム計画によりヒトの全DNA配列も解明されました。これにより、ヒトのすべてが明らかになるかと思われました。
しかし、私たち生物の中にはエピジェネティクスというDNAの塩基配列に依存しない遺伝子の調節機構も存在していたのです。しかも、エピジェネティクスの変化は、親から子へと受け継がれることが分かっています。
今後も、エピジェネティクスの研究は、エピジェネティックと疾患、エピジェネティックと遺伝、環境要因が与えるエピジェネティックの変化の解明など、新たな発見に向け続いていきます。
記事執筆:吉田拓実(東京大学大学院 農学生命科学研究科 博士課程修了 博士(農学)/ 再考編集室 編集記者 / さいこうファーム 農場長)
(上記すべて参照:2023-07-02)









