NMRは分光法の1つ
NMRとは、核磁気共鳴(Nuclear Magnetic Resonance)の略称です。NMR分光法では、強い磁場の中に試料を置き、原子核と電磁場との相互作用を利用して、原子レベルでの構造情報を非破壊的に得ることができます。NMR分光法は、合成した化合物の化学構造の確認やタンパク質の立体構造解析に利用できるため、有機化学者や生化学者にとって重要な分光法の1つです。また、NMRイメージングは、MRI(Magnetic Resonance Imaging)として医療分野で画像診断に欠かせない装置となっています【図1】。
NMRでは全ての原子核を観測できるというわけではありません。原子核が核スピンに伴う磁気モーメントを有する必要があります。「スピン」と粒子が自ら回転することで、粒子が持つ電荷によって磁場モーメントが発生します。核スピンの有無は原子核の陽子と中性子の数に依存します。陽子と中性子の数が共に偶数の場合、核スピンを持ちません。例えば、質量数12の炭素原子(12C)の原子核は陽子6個と中性子6個からなり、核スピンを持たないためNMRで観測できませんが、同位体である質量数13の炭素原子(13C)の原子核は陽子6個と中性子7個からなり、核スピンを持つためNMRで観測できます。次に、有機化合物の測定で最も用いられる質量数1の水素原子1Hを例に、NMRの原理を説明します。
NMRの測定原理
NMRで測定可能な1Hの原子核は、核スピンを有しています。核スピンに伴う磁気モーメントは、静磁場をかけると、静磁場垂直方向の周りに一定の周波数(ラーモア周波数)で歳差運動します。さらに、ラーモア周波数と同じ周波数で回転する磁場をかけると、磁気モーメントのエネルギーが分裂した差に相当する電磁波を吸収して、磁気モーメントの向きが変わりながらエネルギーが高まり、この現象が核磁気共鳴と呼ばれます。また、この電磁場の周波数は、共鳴周波数と呼ばれ、ラジオ波(30MHz以上の高い周波数を持つ電磁波)領域に相当します。
NMRスペクトルでは一般的に、いくつかの吸収ピークが観測され、そのスペクトル形状は分子固有であるため同定に利用できます。スペクトルには、原子数を反映した強度やスピン間の相互作用を反映したピーク分裂、電子的な環境の違いを反映した共鳴周波数の変化(化学シフト)が含まれます。 分子の全ての1Hの原子核が、同じ共鳴周波数で吸収するわけではありません。 外部磁場をかけた場合、原子核だけでなく周りの電子にも作用し、かけた磁場の向きとは逆に誘導磁場を生じること(遮蔽効果)により、原子核にかかる実効的な磁場の強さが小さくなります。その結果、共鳴周波数が小さくなります。遮蔽効果の度合いは、対象の原子核の周りの電子的環境に依存するため、結合原子や周りの官能基によって変わります。そのため、同じ電子的環境にない水素原子核が存在すると、それに対応してNMRスペクトルで異なるピークとして観測されます。例えば、電気陰性度の高い原子や電子吸引性の置換基が隣接すると、1Hの原子核の周りの電子密度が低下するため、遮蔽効果が小さくなり、共鳴周波数は大きくなります。
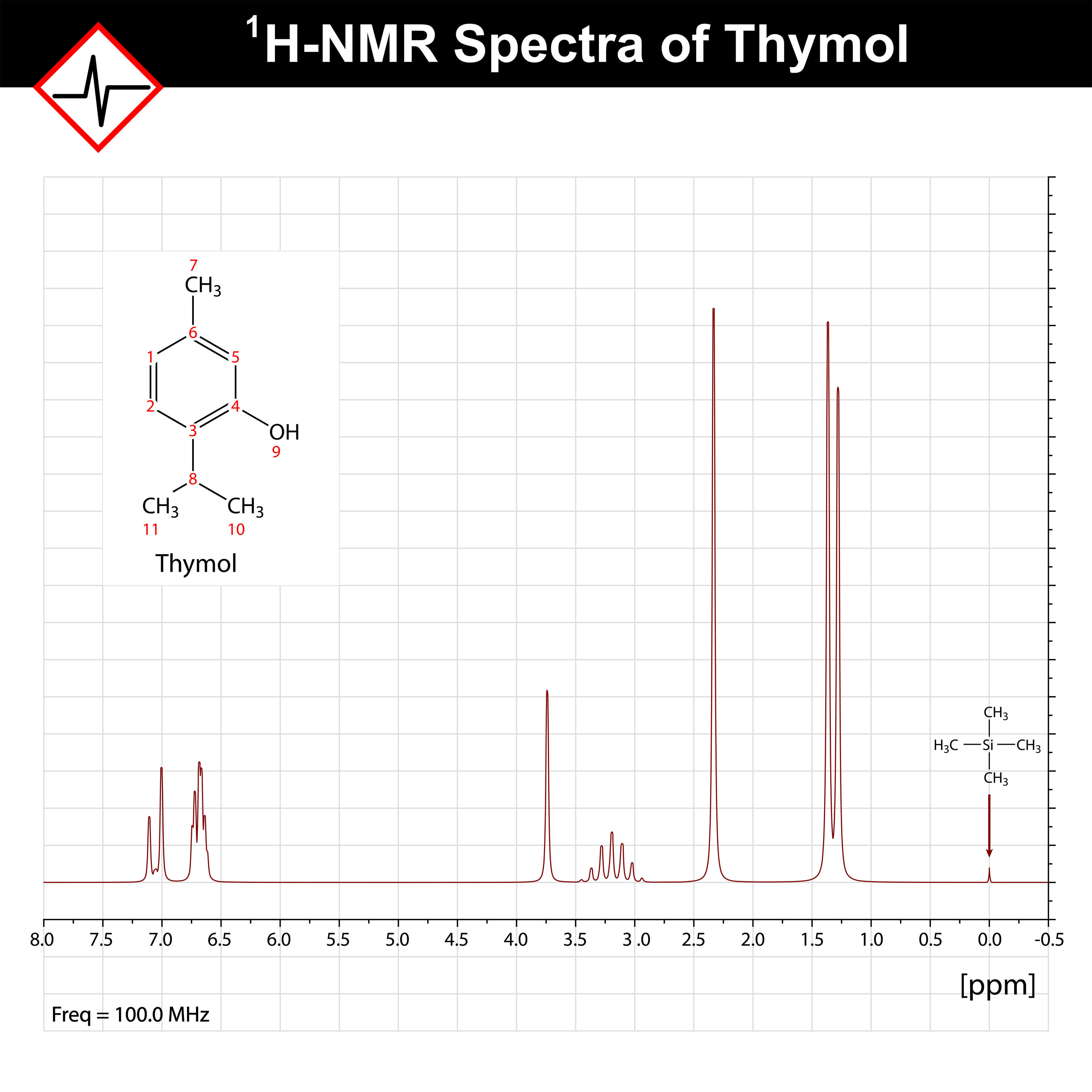
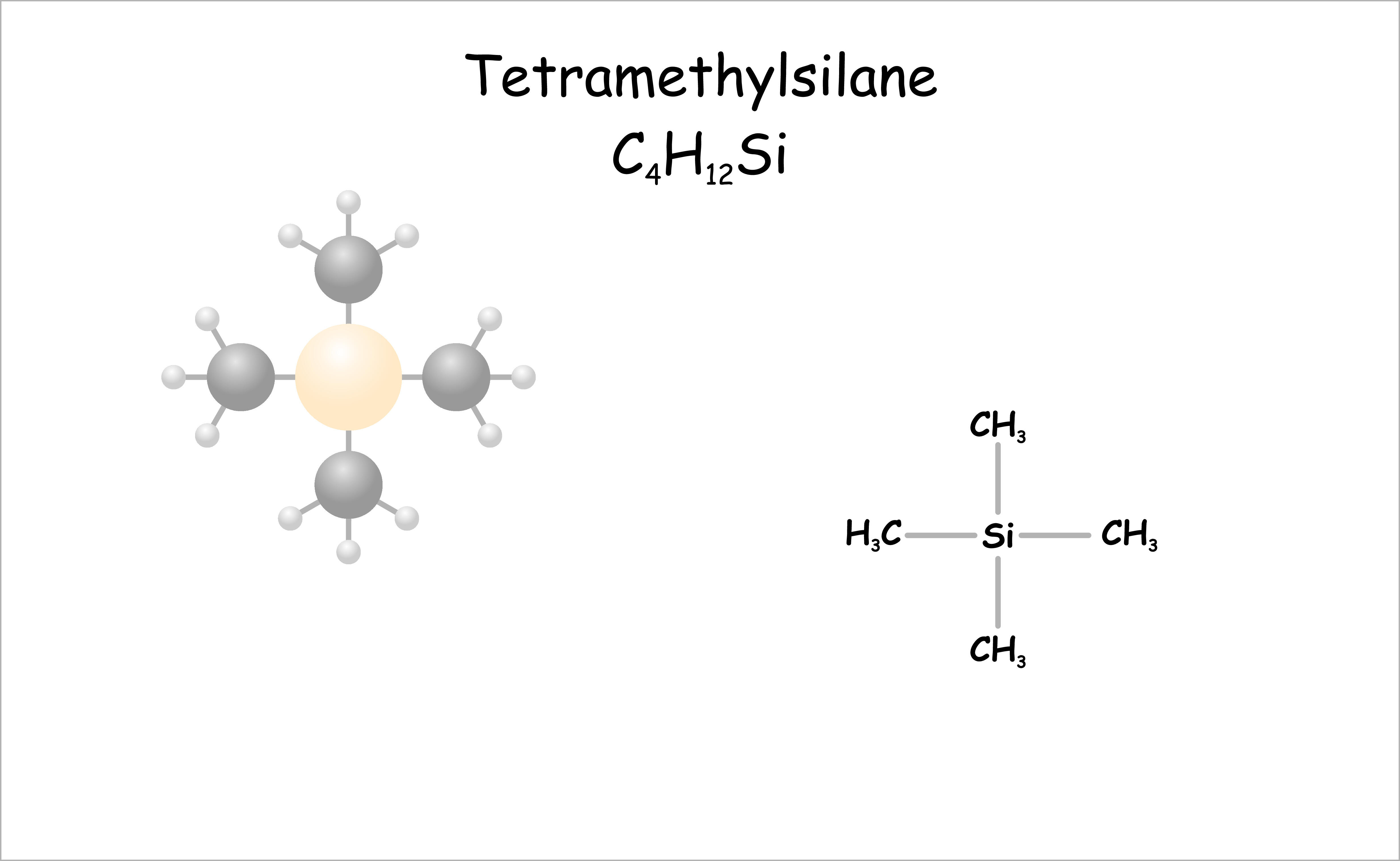
NMRスペクトル【図2】は、実験に用いる磁場の大きさに関係なく同じように表記できるように、基準物質からの共鳴周波数のずれを測定周波数で割って、横軸を無次元の100万分率(ppm:parts per million)で表記します。基準物質には、試料と同じ重水素置換した溶媒に加えたテトラメチルシランSi(CH3)4【図3】が用いられます。テトラメチルシランが用いられる理由として、周りの電子的環境がすべて同じ水素原子で構成され、かつ化学的にも安定で、一般的な有機化学物の水素原子より低磁場側で吸収することなどが挙げられます。また、重水素置換した溶媒を用いるのは、試料の 1H 信号が溶媒の 1H 信号と重なることを防ぐためです。テトラメチルシランからの共鳴周波数のずれを化学シフトと呼びます。どのような官能基により、遮蔽効果の大きさ、つまり、化学シフトがどれくらいかはすでに知られているため、ピーク分裂の本数や強度からの水素原子数の情報と合わせて、合成した化合物が目的の化合物かどうかをNMRで調べることができるのです。
試料は通常、溶液状態で測定されますが、固体(や気体)でも測定が可能です。試料に磁場をかけてラジオ波を照射し、共鳴/緩和(共鳴した磁気モーメントがエネルギーを失い元の状態に戻ること)時の核スピンの応答を試料周りに配置した検出コイルで電圧として測定します。測定では、ラジオ波の周波数か磁場の大きさを掃引して共鳴時の各スピン信号を読み取る方法やさまざまな周波数成分のラジオ波を照射し、信号をコンピュータで波数成分ごとに分離(フーリエ変換)する方法があります。現在は、極短時間のパルス電磁波を照射し、共鳴後の緩和信号をフーリエ変換してNMRスペクトルを得る方法が一般的です。
NMRによるタンパク質の立体構造解析
タンパク質の立体構造を決めるために最も用いられている手法は、X 線結晶構造解析です。しかし、タンパク質の立体構造は、柔軟で溶媒環境などにより変化するため、実際に生理活性を示すような温度/pHでの溶液環境下での構造を調べることが重要なときに、NMRは有効な手法になります。また、結晶化の難しい試料に対しても構造解析ができるというメリットもあります。NMRを溶液試料のタンパク質に適応することで、環境変化に応じた動的な立体構造変化を追跡することも可能です。
原理で述べたように、NMRで観測できるのは、核スピンを持つ1Hや13C、他には15Nや31Pなどの原子核です。天然に存在するタンパク質を構成する主な原子は、H、C、N、Oの4種類ですが、このうち12Cと16Oは、核スピンを持たないためNMRを示さず、14NはNMRを示すものの感度が低いという問題があります。天然での存在割合が小さい同位体は、そのままでは観測に向きません。そこで、13Cと15Nの同位体を利用します。タンパク質中の窒素や炭素を同位体に置き換えるためには、遺伝子工学的手法によりタンパク質を大腸菌に発現させる際に、窒素と炭素の同位体に置き換えた培地で大腸菌を培養します。
数百程度のアミノ酸からなる小さなタンパク質でも、水素原子の数は、千を超えるため、NMRスペクトルは極めて複雑で、アミノ酸の化学構造を反映した複数の領域に、多くのピークが重なり合ったスペクトルとなってしまいます。そこで、1Hと水素以外の原子核を対象にスピン間の相互作用する相手の原子を調べていくなどの、多次元NMRスペクトルが利用されます。水素原子に隣り合う炭素や窒素原子との相互作用による、多次元的な相関から、アミノ酸の二面角や原子間距離の情報を得て、タンパク質の立体構造を決定できるのです。
有機化学や生化学、医学において重要な分光法である、NMRについて解説いたしました。近年、実環境下で測定する分光法が注目されています。NMRは、細胞内の生理環境下にあるタンパク質の動的構造変化を調べる研究にも応用されています。実際のタンパク質の構造は、創薬研究において役立てられるため、NMRは最先端の研究で活躍しています。
記事監修:秋津貴城(東京理科大学 理学部第二部 化学科 教授)